Apaf-1様蛋白:新しい炎症と細胞死シグナルの接点
Apaf-1 like proteins at a crossroads of
apoptosis and inflammation
細胞工学第 24巻、No.9、929−933頁 2005年
須田貴司 Takashi
Suda
要旨
最近、Apaf-1と類似の構造を持つ蛋白が多数発見された。それらの多くはアポトーシスや炎症の誘導・制御に関与する。例えばNod1やNod2は細胞質で細菌の浸入を感知し、アポトーシスや自然免疫を誘導する。CARD12やクリオピリンなどはカスパーゼ1を活性化し、炎症性サイトカインを活性化させる。我々が発見したPYNODなどはアポトーシスと炎症を抑制する分子らしい。Apaf-1様蛋白の変異は様々な疾患などの原因になる。
キーワード
炎症、アポトーシス、カスパーゼ、Apaf-1様蛋白、自然免疫
はじめに
「アポトーシスは炎症を誘導しない細胞死」と言われる。発生過程のプログラム細胞死など生理的な細胞死の多くがアポトーシスであり、そのような場合に炎症が起こることは不都合であろう。しかし、ウイルスが感染した細胞などがアポトーシスを起した場合に炎症が起きないというのは不都合である。実際、炎症の場では活性酸素やデス因子がアポトーシスを誘導するし、アポトーシスによって炎症が誘導される場合もある(1)。
アポトーシスと炎症誘導のシグナル伝達機構には共通点や接点が多い(図1)。例えば、カスパーゼと言えばアポトーシスを連想するが、世界で最初に発見されたカスパーゼ、カスパーゼ1は炎症性サイトカインIL-1bを不活性な前駆体蛋白(pro-IL-1b)から活性のある成熟IL-1b蛋白に転換する代表的な酵素である。カスパーゼ1以外にも、炎症と関連するカスパーゼは多い。カスパーゼ11(ヒト カスパーゼ5のオルソログ)欠損マウスは、カスパーゼ1欠損マウス同様、リポポリサッカライド刺激によるIL-1b産生が著しく抑制されている。カスパーゼ3は、その活性化がアポトーシスの指標にされているが、pro-IL-16の活性型を触媒する(2)。また、デス因子(アポトーシス誘導因子)の一つである腫瘍壊死因子は代表的な炎症性サイトカインでもあり、アポトーシス誘導に特化したデス因子と思われていたFasリガンドも炎症の誘導と制御の両方に関与している(1)。Fasリガンドは種々の細胞に対し、アポトーシスばかりでなく転写因子NF-kBの活性化を誘導し、IL-8などの産生を誘導する。カスパーゼ8はFasリガンドによるアポトーシスとNF-kB活性化の両方に関与している(3)。カスパーゼ8はT細胞におけるNF-kBの活性化や血管内皮細胞やマクロファージの分化・成熟にも関与している(4, 5)。
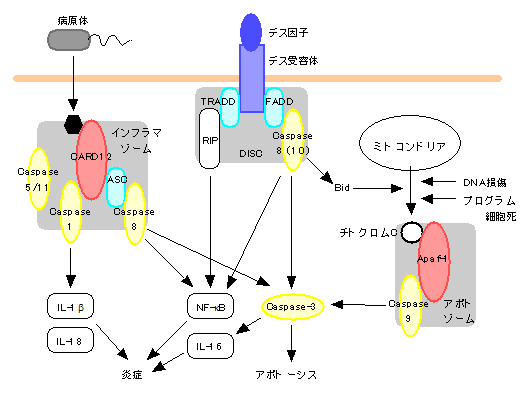
図1. 炎症におけるカスパーゼの役割
カスパーゼ1やカスパーゼ11(ヒトではカスパーゼ5)はIL-1βやIL-18の活性化に重要な役割を果たしている。カスパーゼ9はチトクロムCを認識して多量体化したApaf-1によって活性化されるが、カスパーゼ1やカスパーゼ5はCARD12などの病原体由来物質を認識したApaf-1様蛋白によって活性化されると予想される。カスパーゼ3もIL-16の前駆体ドメインを切断し、活性化を誘導する。カスパーゼ8はT細胞抗原受容体やFas、CARD12を介するNF-kBの活性化に重要な役割を果たしている。
このように、アポトーシスと炎症のシグナル伝達機構の接点が次々と明らかになる中で、最近apoptotic
protease-activating factor (Apaf)-1と類似の構造をもつ20種類を越す蛋白質が発見され、それらが炎症とアポトーシスの誘導や制御に働く分子であることが明らかになってきた(6)(図2B)。本稿では、これらApaf-1様蛋白の構造と機能について概説する。
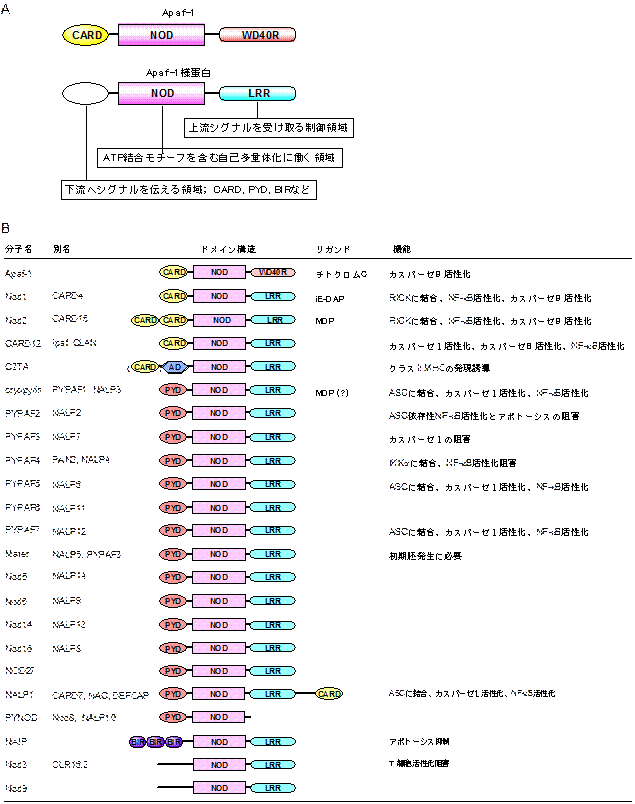
図2. Apaf-1 様蛋白の基本構造と機能
A. Apaf-1 様蛋白は下流にシグナルを伝達するためのエフェクタードメイン、ATPを結合し、自己多量体化に働くNOD、上流のシグナル物質を認識するLRRからなる。B. ゲノム解析などから、ヒトで20腫を越えるApaf-1様蛋白が発見されている。多くのApaf-1様蛋白がアポトーシスと炎症の誘導または制御に働いている。
I. Apaf-1様蛋白の基本構造
Apaf-1は、アミノ末端側から順に、カスパーゼ結合領域(caspase recruitment domain, CARD)、ATPの結合とホモ多量体化に必要な領域(nucleotide-binding oligomerization domain, NOD)、チトクロムCが結合するWD40リピートの3つの領域からなる。アポトーシスの過程でミトコンドリアから放出されたチトクロムCがWD40リピートに結合し、NODにATPかdATPが結合すると7つのApaf-1分子が車輪のスポーク状に集合し、さらにカスパーゼ9と互いのCARDを介して結合し、アポプトゾームと呼ばれる巨大な蛋白複合体を形成する(図3)。
Apaf-1様蛋白の基本構造はApaf-1と類似している(6)(図2A)。Apaf-1と同様、中央にNODを持つことから、Apaf-1様蛋白はNODファミリーとも呼ばれる。アミノ末端側には、下流にシグナルを伝達するためのCARDなどのエフェクタードメインが存在する。CARDと同じデスドメインフォールドと呼ばれる三次構造をもつパイリン領域(pyrin domain, PYD)を持つ仲間も多く、それらは特にPYPAFs(pyrin-containing Apaf-1-like
proteins)またはNALPs(NACHT, Leucine-rich repeats and PYRIN proteins)と呼ばれている。カルボキシル末端にはWD40 リピートの代りに(この領域を欠く一例を除き)ロイシン-リッチ リピート(leucine-rich repeats, LRR)が存在する。Apaf-1のWD40リピートは、通常はApaf-1のホモ多量体化を抑制し、チトクロムCが結合することでその抑制を解除する制御領域であるが、Apaf-1様蛋白のLRRも同様の機能を果たしていると考えられている。
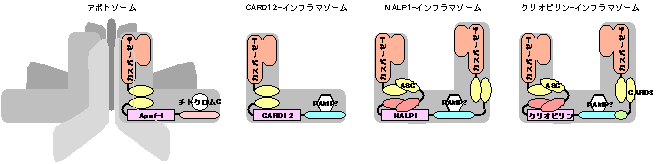
図3. アポトゾームとインフラマゾーム
Apaf-1はチトクロムCが結合すると、車輪のスポーク状の7量体を形成し、カスパーゼ9を結合してアポトゾームを形成する。CARD12、NALP1、クリオピリンなども、何らかの分子を認識すると、カスパーゼ1やカスパーゼ5を結合し、アポトゾーム様の巨大蛋白複合体、インフラマゾームを形成し、カスパーゼ1を活性化して、IL-1βなどのサイトカインの活性化に重要な役割を果たすと考えられる。これらのApaf-1様蛋白はPAMPのセンサーとして働いている可能性がある。
II. Apaf-1様蛋白の機能
1. Nod1, Nod2
Nod1およびNod2はアミノ末端にCARDを持ち、RICK (RIP-like interacting CLARP
kinase)を介してNF-kBを活性化する。Nod1はカスパーゼ9を活性化してアポトーシスも誘導する。最近、Nod1やNod2はそれぞれLRRで異なるタイプの細菌ペプチドクリカンの部分構造、すなわちgD-glutamyl-meso-diaminopimelic acid
(iE-DAP)およびmuramyl dipeptide (MDP)を認識することが明らかにされた(6)。ペプチドクリカンの様な一群の微生物に特徴的な分子構造で、自然免疫系を活性化する物質をpathogen-associated molecular pattern (PAMP)と呼ぶ。哺乳類では細胞表面のトル様受容体群がPAMPを認識して自然免疫を活性化させるセンサーとして働いていることが知られているが、植物ではApaf-1様蛋白と類似の構造を持つ細胞質R蛋白質群がそのような役割を担っている。Nod1やNod2の存在は哺乳類にも細胞質でPAMPを認識するシステムがあることを示す。植物と哺乳類に共通の病原体識別機構が存在するという事実は、自然免疫の起源を考える上で大変興味深い。
ヒトNod2遺伝子には高頻度に突然変異が存在し、Nod2の突然変異はクローン病(炎症性腸疾患の一類型)の危険因子やブラウ症候群(滑膜炎やブドウ膜炎などを特徴とする遺伝性炎症性疾患)の原因になる(7-10)。
2. CARD12
CARD12は、アミノ末端のCARDを介してカスパーゼ1に結合する(11)(図3)。適当な条件でCARD12とカスパーゼ1とpro-IL-1bをヒト胎児腎由来HEK293細胞株に共発現させると、カスパーゼ1の活性化とIL-1bの活性型への転換、分泌が誘導される。CARD12はASC (apoptosis-associated speck-like protein containing a CARD)と呼ばれるPYDとCARDから成るアダプター分子とも結合する。CARD12とASCは互いのCARDで結合し、さらにASCのPYDにカスパーゼ8が結合することにより、アポトーシスやNF-kBの活性化を誘導する(12)(図1)。
CARD12欠損マウス由来のマクロファージは、リポポリサッカライドなどのトル様受容体を介した刺激によるIL-1b産生は正常に起こるが、サルモネラ菌感染によるカスパーゼ1の活性化とIL-1b産生が起きず、サルモネラ感染による細胞死も抑制される(13)。従って、CARD12はサルモネラ菌由来のPAMPを認識する可能性がある。
3. クリオピリン (PYPAF1), PYPAF5, PYPAF7, NALP1
これらはアミノ末端にPYDを持つ仲間である。これらのApaf-1様蛋白はASC と互いのPYDで結合し、さらにASCのCARDを介してカスパーゼ1を結合する。NALP1はアミノ末端のPYDに加え、LRRよりさらにカルボキシル末端にCARDを持つ。Tschoppらは、さらにNALP1のCARDにはカスパーゼ5が結合してインフラマゾームと呼ばれる複合体を形成し、カスパーセ1を活性化するというモデルを提唱している(14)(図3)。クリオピリンなどはカルボキシル末端にCARDを持たないが、彼らのモデルでは代りにCARD8(別名CARDINAL)が複合体に加わり、カスパーゼ5を結合する。マウスでもカスパーゼ11がリポポリサッカライド刺激によるIL-1bの産生に必要であることから、同様の複合体が形成されると考えられるが、マウスにはCARD8が存在せず、他のCARD含有蛋白がこの役割を担っている可能性がある。
これらのApaf-1様蛋白もカルボキシル末端のLRRで何らかの分子を認識する可能性があるが、認識分子は不明である。クリオピリンはMDPを認識すると報告されたが、我々は再現できていない。ASC欠損マウス由来マクロファージでは、トル様受容体刺激とサルモネラ菌感染の両方でカスパーゼ1活性化とIL-1b産生が起こらないことから、トル様受容体の下流のシグナル伝達分子がApaf-1様蛋白のリガンドになっている可能性もある(13)。
クリオピリンの突然変異は家族性寒冷自発性炎症性疾患、マックル-ウエルズ症候群、慢性乳児神経皮膚関節症候群などの遺伝性炎症性疾患の原因となる(15, 16)。ASCに関しては、乳がん、肺がん、メラノーマ、大腸がんなど様々な腫瘍でDNAメチル化により発現が抑制されていること、がん抑制因子p53により発現が誘導されることなどから、がんとの関わりも指摘されている(17, 18)。
4. PYNOD、PYPAF2、PYPAF3、PYPAF4
これらもPYDを持つグループである。我々は、哺乳類のApaf-1様蛋白としては唯一LRRを欠くPYNODを見いだし、その機能を研究している。面白いことにPYNODはASCやカスパーゼ1と結合するが、クリオピリンなどと異なり、それらの活性化を阻害する(19)。ヒトPYPAF2とPYPAF3の遺伝子は相同性が高く、ゲノム上に隣接して存在する。また、マウスには両方の共通のオルソログと考えられる遺伝子が一つしか存在しない。したがって、これらの遺伝子は極最近の遺伝子重複により生じたと考えられる。ヒトPYPAF2はASCによるNF-kBの活性化を阻害するが、カスパーゼ1依存性のIL-1b活性化には影響しない。逆に、PYPAF3はカスパーゼ1依存性のIL-1b活性化を阻害するが、ASCによるNF-kBの活性化には影響しない。おそらく、PYPAF2とPYPAF3はPYNODのように両方の作用をもつ共通の祖先遺伝子から、一つずつ機能を受け継いだのではないだろうか(20)。この他、PAN2(PYPAF4)はIkB kinase (IKK)aに結合し、NF-kBの活性化に働くIKK複合体の活性を阻害することにより、腫瘍壊死因子やIL-1bによるNF-kBの活性化を抑制する(21)。
以上の結果は、Apaf-1様蛋白の中に、炎症抑制性のサブファミリーが存在することを示唆する。ただし、これらの結論は遺伝子過剰発現実験の結果から導かれたものであり、今後、より生理的な実験系で検証される必要がある。
ASCに対する阻害分子としては、PYDの名前の由来になったパイリンが知られている。パイリンはアミノ末端にPYDを持つがNODやLRRは持たず、Apaf-1様蛋白には属さない。パイリン遺伝子の突然変異は家族性地中海熱と呼ばれる遺伝性炎症性疾患の原因となることから、PYNODなども何らかの炎症性疾患に関与している可能性がある(22)。
5. CIITA (Class II Transactivator)
CIITAはアミノ末端に転写活性化領域を持ち、クラスII組織適合性(MHC)抗原の発現に必須の転写因子である。強力な抗原提供細胞として働く樹状細胞では転写活性化領域のさらにアミノ末端側にCARDを持つCIITAのバリアントが発現する。クラスII MHCの発現がないために重篤な免疫不全症を示す2型ベアーリンフォサイト症候群の一部の患者でCIITAの遺伝子が欠損している(23)。
6. NAIP(Neuronal Apoptosis Inhibitor Protein)
NAIPはアミノ末端にバキュロウイルスIAPリピート(BIR)を有し、cIAP1, cIAP2, XIAPなどと共に IAPファミリーに属する蛋白である。褐色細胞腫由来PC12細胞株にNAIP遺伝子を導入するとアポトーシス抵抗性を獲得する。ヒトNAIP遺伝子は1種類しかない。一型脊髄性筋萎縮症の原因遺伝子であるSurvival of Motor
Neuron (SMN)1, SMN2の近傍に存在し、症状が重篤な患者ではSMN1, SMN2に加え、NAIPも欠失している場合が多い(24)。マウスではゲノム上に隣接して5種類のNAIP(a, b, e-g)遺伝子が存在する。レジオネラ菌感染に感受性の高い系統のマウスでは、NAIP が欠失しており、NAIPe遺伝子を導入することでレジオネラ菌抵抗性を獲得する(25)。NAIPeを導入したマクロファージはレジオネラ菌の細胞内感染に抵抗性を示す。したがって、NAIPは種々の細胞のアポトーシス抵抗性に寄与していると考えられる。
7. Nod3
Nod3
(CLR16.2)はアミノ末端に100アミノ酸程度の他の既知の蛋白と明瞭な相同性のない領域を持つ。Nod3はT細胞やナチュラルキラー細胞に発現し、T細胞を活性化すると、Nod3の発現が減少する。Nod3をT細胞白血病由来Jurkat細胞株に発現させると、T細胞受容体を介する刺激によるNF-kB、NFAT、AP-1などの転写因子の活性化が抑制され、IL-2やCD25の発現が抑制される。これらのことから、Nod3はT細胞などの活性化を抑制する分子であると考えられる(26)。
おわりに
以上のように、Apaf-1様蛋白はアポトーシスと炎症の誘導や制御に関与している分子であることが明らかになってきた。CARD12やクリオパイリンなどは、その機能からNod1やNod2のように病原体センサーとして働いている可能性もあり、それらのリガンドの同定が一つの焦点になっている。また、複数のApaf-1様蛋白やそれらの関連因子が炎症性疾患に関与しており、がんとの関わりも示唆されていることから、Apaf-1様蛋白の活性の制御機構の解明も期待される。その意味で、PYNODなどの抑制性Apaf-1様蛋白のサブファミリーの研究も重要になってくると思われる。
文献
1. 須田貴司: 実験医学 (2001) 19: 198-205
2. Zhang Y, et al. : J
Biol Chem (1998) 273: 1144-1149.
3. Imamura R, et al. : J.
Biol. Chem. (2004) 279: 46415-46423
4. Su H, et al. : Science
(2005) 307: 1465-1468.
5. Kang TB, et al. : J
Immunol (2004) 173: 2976-2984.
6. Inohara N, et al. :
Nat. Rev. Immunol. (2003) 3: 371-382.
7. Hugot JP, et al. :
Nature (2001) 411: 599-603.
8. Hampe J, et al. :
Lancet (2001) 357: 1925-1928.
9. Ogura Y, et al. :
Nature (2001) 411: 603-606.
10. Miceli-Richard C, et al. : Nat
Genet (2001) 29: 19-20.
11. Poyet JL, et al. : J. Biol. Chem.
(2001) 276: 28309-28313.
12. Hasegawa M, et al. : J. Biol. Chem.
(2005) 280: 15122-15130
13. Mariathasan S, et al. : Nature
(2004) 430: 213-218
14. Martinon F, et al. : Cell (2004)
117: 561-574.
15. Hoffman HM, et al. : Nat. Genet.
(2001) 29: 301-305.
16. Feldmann J, et al. : Am J Hum Genet
(2002) 71: 198-203. Epub 2002 May 2024.
17. McConnell BB, et al. : Apoptosis
(2004) 9: 5-18.
18. Ohtsuka T, et al. : Nat. Cell.
Biol. (2004) 6: 121-128
19. Wang Y, et al. : Int. Immunol.
(2004) 16: 777-786
20. Kinoshita T, et al. : J Biol Chem
(2005) 6: 6
21. Fiorentino L, et al. : J. Biol.
Chem. (2002) 277: 35333-35340.
22. The-International-FMF-Consortium. :
Cell (1997) 90: 797-807
23. Reith W, et al. : Annu Rev Immunol
(2001) 19: 331-373.
24. Roy N, et al. : Cell (1995) 80:
167-178.
25. Diez E, et al. : Nat Genet (2003)
33: 55-60. Epub 2002 Dec 2016.
26. Conti BJ, et al. : J. Biol. Chem.
(2005) 280: 18375-18385