アポトーシスの生理的・病理的意義
Physiological and pathological roles of apoptosis
須田貴司
金沢大学がん研究所分子標的薬剤開発センター
Takashi Suda
Center for the Development of Molecular Target Drugs, Cancer Research Institute, Kanazawa University
(臨床免疫学 上、日本臨床 63巻増刊号4 P395-400, 2005)
キーワード
アポトーシス、発生、自己寛容、炎症、がん
はじめに
我々の体 を構成する個々の細胞の死は、多くの場合、細胞自身の“自爆プログラム”の発動による積極的な反応である。たとえそれが外的な要因によって誘導されたもの だとしても、最終的には死んでいく細胞自身の“自爆プログラム”が活性化して、適切に死んでいく場合が多い。この様な場合、細胞はアポトーシスと呼ばれる 特徴的な細胞の形態変化、生化学的変化を伴う死に方をする。細胞が“積極的に死ぬ”という反応は、形態形成、細胞数のホメオスタシス、がん抑制、感染防御 などの目的に役立っており、細胞の重要な機能の一つと言える。一方、AIDS、劇症肝炎などの炎症性疾患などでは過剰な細胞死が病態形成に根本的な係わりを持っている。このような場合の細胞死もアポトーシスによるものが多く、「アポトーシスは諸刃の剣」といわれる所以である。本稿では、アポトーシスの生理的役割や疾患との関連を免疫・炎症に重心をおいて概説する。
1. 免疫系の発生、自己寛容におけるアポトーシス
個体発生の過程で特定の細胞が特定の時期に細胞死を引き起こして消失することが遺伝的にプログラムされている。Horvitz博士らがこのプログラム細胞死と呼ばれる現象を、線虫を用いて遺伝学的に解明し、2002年 のノーベル医学生理学賞を受賞したことは記憶に新しい。オタマジャクシがカエルになる過程で尻尾が消えるのも、人間の手に水かきがないのもプログラム細胞 死のお陰である。個体発生の過程では、神経細胞なども必要以上に産み出され、必要な分だけ生き残り、過剰な細胞はアポトーシスをおこして死んでいく。免疫 系においても、細胞数のホメオスタシスや自己反応性リンパ球の排除などの目的で、アポトーシスが重要な役割を果たしている。
1-a. 血液系細胞のアポトーシス
免疫系で中心的な役割を果たす血液系の細胞は、古くなるとアポトーシスを起して除かれ、常に骨髄の造血系 幹細胞から新しい血球細胞が産み出されている。すなわち、個体として成熟した後も血球系では発生が繰り返されている。新しい血球系細胞が産み出される過程 でも、途中段階の未熟な細胞(前駆細胞)が必要以上に産み出され、過剰な分はアポトーシスにより除かれることで細胞数のホメオスタシスが維持されている。 この様な細胞死は生存因子の量や生存因子を横取りしてしまうデコイ(おとり)受容体の量などによって規定される1)(図1)。このようなシステムは無駄なように思われるが、緊急時には生存因子の量を増やしたりデコイ受容体の量を減らすことで速やかに血球を供給できるというメリットがある。
役目を終えた血球細胞の死もアポトーシスであると考えられる。好中球の寿命が短いことは有名であるが、培養液中でも2日で約半数が死ぬ。しかし、アポトーシス抑制因子Bcl-2を過剰発現させた好中球は大幅に寿命が延びる。ただし、血中の好中球数はそれほど増えない。これは古くなった好中球を、アポトーシスを起しているか否かにかかわらす、マクロファージが貪食するためと考えられている2)。
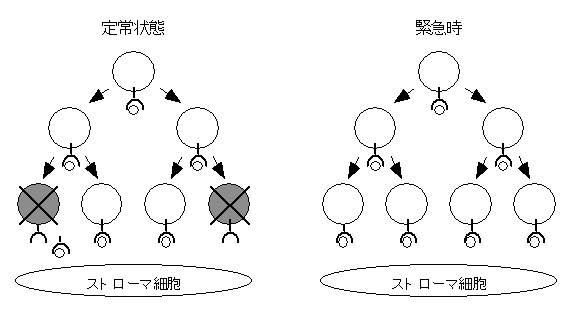
図 1. アポトーシスによる血液系前駆細胞数の制御
定常状態では、ストローマ細胞の産生する生存因子の量や前駆細胞自身を含む周辺の細胞が産生するデコイ受容体の量によって前駆細胞の数が制限される。緊急時には生存因子の産生量が増えたりデコイ受容体の量が減ることにより、速やかに血球細胞を産み出せると考えられる。
1-b. T・B細胞のアポトーシス
T細胞やB細胞は外来の異物を認識して排除し、自己には寛容な抗原特異性のレパートリーを作り出すために、発生の過程で繰り返し生か死かの選択を受ける3)。T細胞のセレクションのメカニズムについてはIX-1-1)、2)で詳しく述べられると思うので、ここでは割愛する。また、T・B細胞のセレクションのメカニズムに関しては、最近の鍔田氏の総説でも詳しく述べられている4)。スペースが限られているので、ここでは他では余り触れられないと思われるFas-Fasリガンド系によるB細胞アポトーシス制御についてのみ補足する。
FasやFasリガンドの突然変異(lprおよびgld)はリンパ球増多症と自己抗体による自己免疫疾患を引き起こす。細胞数の増加はT細胞に顕著に現れるが、B細胞の数も実際にはかなり増える。MRL/lprマウスのT細胞にのみFasの発現を回復させたトランスジェニックマウスでは、T細胞の数はほぼ正常化し、B細胞数の増加が明瞭になる。また、このマウスではリンパ腫はほぼ消失するが、自己抗体の産生はあまり低下しない5)。一方、T細胞とB細胞の両方にFasの発現を回復させた場合は、B細胞の数も正常化し、自己抗体の産生も低下する6)。これらの結果から、Fas-Fasリガンド系はB細胞のアポトーシスや自己抗体の産生抑制に寄与していると考えられる。
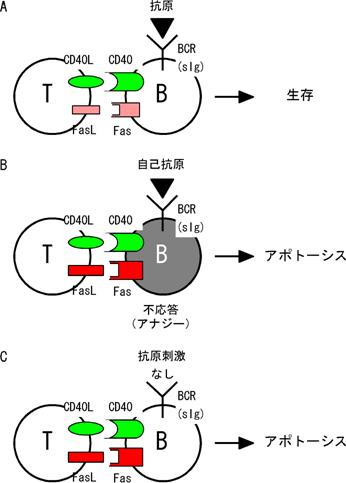
B細胞はCD40リガンドの刺激を受けるとFasの発現が上昇し、Fasリガンド感受性が著しく増大する。しかし、同時に抗原受容体(細胞表面抗体)から刺激を受けるとFasリガンド刺激に対し抵抗性を獲得する。すなわち、FasリガンドはT細胞からの補助刺激のみを受け、抗原刺激を受けなかったB細胞に対し選択的にアポトーシスを誘導すると考えられる(図2)。このような現象は、アナジー(抗原刺激に応答できない状態)に陥った自己反応性B細胞や抗体遺伝子の体細胞突然変異(抗原結合能の強い抗体を産み出す目的で抗原刺激を受けたB細胞の一部が高い頻度で抗体遺伝子に突然変異を起す)で抗原結合能が減弱してしまったB細胞の排除などに役立っていると考えられる 7, 8)。
|
|
図2. FasリガンドとCD40リガンドによるB細胞のアポトーシス制御 抗原受容体から刺激を受けているとき(A)は、ヘルパーT細胞などからCD40とFasからの刺激を受けても細胞死を起さない。むしろCD40からのシグナルは抗原受容体刺激による細胞死を抑制する。ところが、自己抗原に不応答になっているB細胞(B)や親和性成熟などの過程で抗原親和性が低下してしまったB細胞(C)は、CD40からのシグナルでFasの発現量が増加し、Fasリガンドによるアポトーシスを起こす。 |
2. 細胞傷害とアポトーシス
細胞傷害性T細胞やナチュラルキラー(NK)細胞はウイルス感染細胞やがん細胞を殺傷する。これは一見他殺の様に見えるが、死んでいくウイルス感染細胞やがん細胞はアポトーシスで死ぬことが分っている。その意味で、T細胞やNK細胞は標的細胞を殺していると言うより、標的細胞に自殺を促しているという方が正確である。このメカニズムについてはIII-4-2)や筆者の総説3)を参照していただきたい。
3. アポトーシスと炎症
一般にア ポトーシスは炎症を誘導しない細胞死と言われている。しかし、アポトーシスも炎症も異物あるいは異物化された自己を排除するための機構であり、しかもアポ トーシスと炎症の分子機構には高い類似性がある。従って、これらの二つの機構は同一の祖先的機構から、機能的にも密接な関連を保ちながら進化してきたもの と考えられる。実際、炎症の過程では排除される細胞も炎症細胞もアポトーシスを起すし、アポトーシスが炎症を促進する場合すらあることが明らかになってき た。
3-a. アポトーシスと炎症の分子機構の類似性
アポトーシスと炎症の分子機構には類似性がある9)。カスパーゼはアポトーシスで重要な役割を果たす蛋白分解酵素であるが、カスパーゼ1を初め複数のカスパーゼがIL-1βなどの炎症性サイトカインの活性化に働いている。最近、Apaf-1(IX-2-2)参照)と類似の構造をもつ複数の細胞内蛋白が、カスパーゼ1の活性化とIL-1βの分泌に重要な働きを担っていることが明らかになりつつある10)。その他のものも含め、現在ヒトで23種類のApaf-1様分子をコードする遺伝子が見いだされており、その多くが免疫・炎症とアポトーシスの両方に関与していることが示されつつある。デス因子-デス受容体も然りである。TNFαはアポトーシスを誘導するデス因子であると同時に、転写因子NF-kBの活性化を誘導し、様々なサイトカインの産生を誘導する代表的な炎症性サイトカインの一つである。
3-b. Fasリガンドの炎症誘導機構
TNFよりアポトーシスに専門的と考えられていたFasリガンドも生体内では炎症誘導作用を示す。我々は、Fasリガンドの炎症誘導作用の分子機構を調べてきたが、いくつか面白いことが分った。先ず、Fasリガンドは好中球やマクロファージなどの炎症細胞にアポトーシスを誘導すると、カスパーゼの活性化に伴ってIL-1βなどが活性化され、炎症が促進される9)。炎症細胞のアポトーシスは必ずしも炎症の終息にはつながらないのである。
FasリガンドはNF-kBの活性化も誘導し、IL-8などの産生を誘導する。驚いたことに、このNF-kBの活性化やIL-8の産生にはカスパーゼ8が必須であり、カスパーゼ8の阻害蛋白であるFLIPにより阻害される11)。つまり、カスパーゼ8も炎症誘導に係わると考えられる。最近カスパーゼ8をT細胞やマクロファージ、血管内皮細胞などで欠損させると、それらの系列の細胞の発生が著しく阻害されることが報告され、カスパーゼ8がアポトーシス誘導以外の機能を持っていることが示唆されている12)。ショウジョウバエでは、細胞表面ペプチドグリカン結合蛋白の下流でカスパーゼ8のホモログであるDREDDが、NF-kBホモログであるRelishを切断して活性化するために働いていることが知られている。哺乳類でも同様のメカニズムが存在するのかもしれない。
4.NF-kB活性化によるアポトーシス抑制の意義とリスク
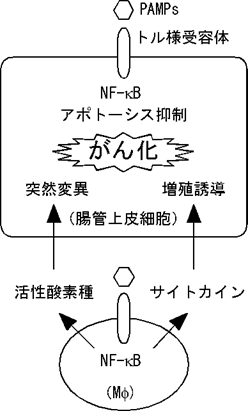
NF-kBの活性化は免疫・炎症反応を惹起すると同時にアポトーシスの抑制にも働く。良く言われるようにアポトーシスの目的の一つががんを抑制することであり、また炎症ががんの発生しやすい環境を作りだすとすると、NF-kBの活性化は、二重にがんの原因を作りだすことになる。最近Gretenら13) はNF-kBの活性化に重要な役割を果たすIKKβの腸管上皮特異的な欠損マウスと骨髄球系特異的な欠損マウスを用いて、この考えに合致する結果を報告している。野生型マウスに低用量の発がん剤azoxymethaneを投与した後に、硫酸デキストランナトリウム (DSS)を飲み水に混ぜて、定期的に腸炎を誘導すると、高い頻度で大腸がんが発生する。彼らはこの炎症随伴発がんモデルで、腸管上皮細胞特異的にIKKβを欠失したマウスでは、野生型マウスに比べDSS投与直後に起きる腸管上皮細胞のアポトーシスが亢進し、腫瘤の数が著しく減少する事を示した。一方、骨髄球系細胞特異的にIKKβを欠失したマウスでは、DSS投与後の炎症が抑制され、個々の腫瘤の大きさ小さくなった。これらの結果は、腸管上皮細胞でのNF-kBの活性化はアポトーシスを抑制し、結果としてがんの発生率を高め、一方炎症細胞でのNF-kBの活性化はサイトカインの産生を誘導し、それが腸管上皮細胞の増殖を誘導してがんの進展を促したと解釈しうる(図3)。
|
|
図3. NF-kBによるアポトーシスの抑制とがん 腸管では常在細菌に由来するPAMPsにより常にNF-kBの活性化が誘導されている。このNF-kBの活性化は上皮細胞に一定のアポトーシス抵抗性を付与している。しかし、何らかの原因で慢性的な炎症が起きると、炎症細胞に由来する活性酸素種などが突然変異を誘発し、さらにサイトカインにより細胞増殖が誘導されることにより、がんが発生しやすい状態になると考えられる。 |
では、腸管上皮細胞におけるNF-kBの活性化によるアポトーシスの抑制にはどのような意義があるのだろうか。その疑問に対しては、Rakoff-Nahoumら14)の報告が一つの示唆を与える。彼らは、MyD88やトル様受容体のノックアウトマウスは野生型マウスと比較し、経口DSS投与により激しい腸炎を起こし、死にやすいことを示した。同様の現象は抗生物質混合物の投与で腸内細菌を全滅させた時にも起きた。これらの結果は、腸管内細菌叢によるトル様受容体を介した刺激が、腸管上皮細胞に(多分NF-kBの活性化を介して)一定のアポトーシス抵抗性を付与していることを示す。
これら二つの論文の結果を総合すると、腸管上皮細胞におけるNF-kBの活性化はアポトーシス抵抗性を誘導し、様々な細胞傷害刺激に対する抵抗性を付与しているが、その分発がんリスクを上昇させていると考えられる(図3)。
Fasリガンドによるアポトーシスと炎症性疾患とがん
我々は、Fasリガンドを中和することで、肝炎などの炎症性疾患の動物モデルで治療効果があることを示してきた。しかし、実際の肝炎では、慢性化して肝がんへ進展することが問題になっている。Fasリガンドがアポトーシス誘導因子であることを考えると、Fasリガンドの活性を抑制すると、肝炎は良くなっても肝がん発症リスクは上昇してしまいそうである。どころが、慢性肝炎から肝がんを発症する動物モデルでFasリガンド中和抗体投与の効果を検討したところ、肝炎が軽快するばかりでなく、肝がんの発症率も著しく減少した15)。この結果はアポトーシスが発がんの抑制に役立っているという考えを否定するものではない。多分、抗体がアポトーシスを抑制したことより、肝がん発生の原因となる炎症を取り除いたことの効果の方が大きかったためと解釈できる。Fasリガンドを抑制しただけで、全てのアポトーシスが抑制されるわけではないので、がん化しそうな細胞のアポトーシスは正常に起こったのかもしれない。ただ、抗Fasリガンド抗体の肝がん予防効果は、アポトーシス=がんの抑制という図式だけでは説明できず、アポトーシスと炎症の関連を念頭において理解する必要があると思われる。
おわりに
劇症肝炎、エイズ、神経組織や筋組織の 変性性疾患など細胞死が病態形成や死因に本質的に関わっている疾患は数多い。逆に自己免疫疾患やがんの様に起きるべき細胞死が起きないために起きる病気も ある。この様な疾患に対しアポトーシスをコントロールすることで対処出来ないか検討することは意義がある。しかし、そのためには、アポトーシスそのものが 諸刃の剣であるうえに、炎症とも複雑な関連を持つことを充分に理解する必要があると思われる。本稿が、細胞死の係わる疾患の病理・病態の理解や治療法の開発に少しでも寄与することができれば、望外の喜びである。
文献
1) Park J R : Cytokine regulation of apoptosis in hematopoietic precursor cells. Curr Opin Hematol 3: 191-196, 1996.
2) Lagasse E, Weissman I L: bcl-2 inhibits apoptosis of neutrophils but not their engulfment by macrophages. J Exp Med 179: 1047-1052, 1994.
3) 須田貴司: 免疫とアポトーシス. 遺伝子医学 3: 101-108, 1999.
4) 鍔田武志: リンパ球選択とアポトーシス. 実験医学 増刊 22: 163-169, 2004.
5) Fukuyama H, et al: Transgenic expression of Fas in T cells blocks lymphoproliferation but not autoimmune disease in MRL-lpr mice. J Immunol 160: 3805-3811, 1998
6) Fukuyama H, et al: Requirement of Fas expression in B cells for tolerance induction. Eur J Immunol 32: 223-230, 2002.
7) Rathmell J C, et al: CD95 (Fas)-dependent elimination of self-reactive B cells upon interaction with CD4+ T cells. Nature 376: 181-184, 1995.
8) Hennino A, et al: FLICE-inhibitory protein is a key regulator of germinal center B cell apoptosis. J Exp Med 193: 447-458, 2001.
9) 須田貴司: アポトーシスと炎症は親戚関係. 実験医学 増刊 19: 198-205, 2001.
10) Inohara N, Nunez G: NODs: intracellular proteins involved in inflammation and apoptosis. Nat Rev Immunol 3: 371-382, 2003.
11) Imamura R, et al: Fas ligand induces cell-autonomous NF-kappa B activation and IL-8 production by a mechanism distinct from that of TNF-alpha. J Biol Chem in press, 2004.
12) Kang T B, et al: Caspase-8 serves both apoptotic and nonapoptotic roles. J Immunol 173: 2976-2984, 2004.
13) Greten F R, et al: IKKb links inflammation and tumorigenesis in a mouse model of colitis-associated cancer. Cell 118: 285-296, 2004.
14) Rakoff-Nahoum S, et al: Recognition of commensal microflora by toll-like receptors is required for intestinal homeostasis. Cell 118: 229-241, 2004
15) Nakamoto Y, et al: Prevention of hepatocellular carcinoma development associated with chronic hepatitis by anti-fas ligand antibody therapy. J Exp Med 196: 1105-1111, 2002.