FasとFasリガンド
須田 貴司(金沢大学がん研究所附属分子標的薬剤開発センター)
(バイオサイエンスの新世紀 シリーズ6 細胞の誕生と死 長田重一、山本 雅 編 p143-159, 2001)
サマリー:
Fasリガンドは受容体Fasに結合すると細胞にアポトーシスを誘導するサイトカイン=デス因子である.生理的な単一蛋白による細胞外からの刺激で,アポトーシスを誘導することが出来ることから,アポトーシスのシグナル伝達研究の重要なツールになった.また,FasとFasリガンドはその発見の直後に,自己免疫疾患のモデル動物とされていた自然発生突然変異マウスの原因遺伝子である事が明らかとなり,その医学的重要性も加わって,爆発的な勢いで研究された.その結果,Fasリガンドは免疫系のホメオスタシスや自己寛容において,また細胞傷害性T細胞の細胞傷害分子として重要な役割を果たしていることが明らかになった.これらの生理的機能の裏返しとして,Fas-Fasリガンド系の機能低下は自己免疫疾患の原因となり,機能亢進は劇症性肝炎などの炎症性疾患の原因になることが明らかになって来た.
はじめに
「個々の細胞が必要に応じて積極的に死ぬこと」は細胞の増殖や分化と同様,多細胞生物の発生と生命維持に必須な細胞の機能である.このような機能的細胞死の中で,最も代表的なものがアポトーシスである.そして増殖や分化と同様に,細胞死もまた細胞間相互作用によって高度な制御を受けている.このことを端的に示すのが細胞増殖因子や分化因子に相当する,細胞の死を制御するサイトカイン,すなわちデス因子の存在である.現在哺乳類では5種類のデス因子が知られているが,全てTNFファミリーに属する分子であり,それらの受容体は,TNF受容体ファミリーに属する.中でもFas-Fasリガンド系は最もアポトーシス誘導に専門化したシステムで,デス因子とその受容体のプロトタイプである.ここでは,FasとFasリガンドの発見から,構造,シグナル伝達,生理的役割,病気との関係について概説する.
1. FasとFasリガンドの発見
1-A. Fasの発見
Fasは,ヒト線維芽細胞FS7をマウスに免疫して得られたIgMクラスのモノクローナル抗体により認識される抗原として,京都大学 (当時,都立臨床研) の米原伸一博士により発見された(1).この抗体は補体非依存性に,FS7をはじめ多くのヒト細胞株に細胞死を誘導する能力を有していた.抗体が血清中に含まれる補体と呼ばれる複数の蛋白成分と協調的に働いて,細菌やウイルス感染細胞を殺すことは,免疫学をかじったことのある者なら誰でも知っている有名な現象である.しかし,補体の非存在下で細胞を殺せる抗体があるというのは,当時としては"非常識"な発見で,この事実を発表するのに米原博士が如何に御苦労されたかは想像に難くない.Trauthらも,同様の活性を示す抗体(抗Apo-1抗体)を樹立したが(2),後にApo-1とFasは同一分子であることが明かとなった.この他,Fas/Apo-1はCD95とも呼ばれる.
1991年に筆者の元上司でありこの巻の編者でもある長田重一博士 (当時,大阪バイオサイエンス研究所) と米原博士との共同研究でFasの遺伝子がクローニングされ,初めてFasは広く認知されることになった(3).Fas遺伝子はtumor necrosis factor (TNF) 受容体に似た膜貫通分子をコードしていた.細胞死を誘導する抗体は,細胞の生存に必須の増殖因子受容体に対する阻害抗体である可能性もあった.しかし,クローニングされたFas遺伝子を通常の培地中でよく増殖するがん細胞に発現させ,抗Fas抗体で処理するとがん細胞は速やかにアポトーシスの特徴を示して死滅した(図1).すなわちFasはデス因子の受容体であることがほぼ明らかになった.「ほぼ」というのは受容体であることの最終的な証明には,特異的なリガンドの存在を示す必要があるからである.実際,同じころTNFも細胞レベルではネクローシスではなくアポトーシスを誘導することが明らかになり,米原博士はFasがTNF受容体のシグナル伝達に関わるサブユニットである可能性も考えられていたようである.しかし以下に述べるように,現在FasとTNF受容体は別々のリガンドを持つ独立した受容体であることが明らかになっている.
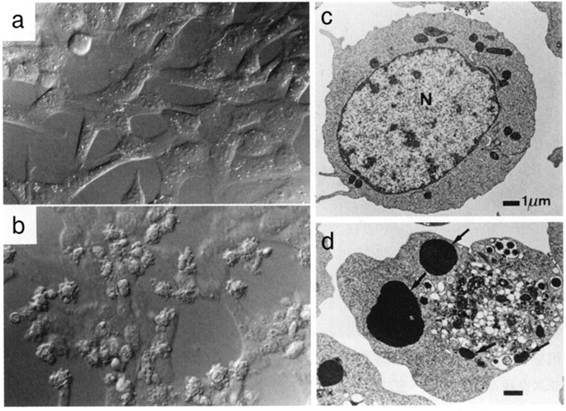
図1:Fasを介した細胞死の形態的特徴
線維芽細胞株 (a,b、ノマルスキー微分干渉像) やリンパ腫細胞 (c,d、透過型電子顕微鏡像) にFas遺伝子を導入し(b,d)、抗Fas抗体で処理すると、泡立つ様な細胞膜の変形 (b) や核の濃縮と断片化 (d,矢印)などのアポトーシスに特徴的な変化が観察される。a,cはFas遺伝子を導入していないコントロール細胞。(写真は長田重一博士の提供)
1-B. Fasリガンドの発見
1992年,長田博士の研究室の研究員として迎えていただいた私は,すぐにFasリガンドを探す準備にかかった.手掛かりはFasだけであったので,Fasの細胞外部分と抗体のFc部分を融合した可溶性のキメラ蛋白質,Fas-Fcを作成した.TNF受容体ファミリー分子の細胞外領域とFcは相性が良いらしく,様々なTNF受容体ファミリー分子のFcキメラ蛋白が作製され,本来の受容体とリガンドを競合する阻害剤として,あるいはリガンドを検出するプローブとして利用されている (注1).また,抗体のFc部分が付いているため,様々な免疫化学的手法(免疫沈降,抗体アフィニティークロマトグラフィー,蛍光抗体染色とフローサイトメトリー等々)が利用できる.実際,Fas-FcはFasリガンドの同定,精製,遺伝子クローニングの全てに大活躍した.Fasリガンドの発見に必要なもう一つの材料は外国から訪れた.INSRM (フランス) のGolstein博士らが,細胞傷害性T細胞株 がFasを発現する標的細胞を殺すことを発見したのである(4).我々はGolstein博士からこの細胞株を譲り受け,Fasリガンドを約40 kDの当タンパク質として精製するとともに、その遺伝子のクローニングに成功した(5).
FasがTNF受容体に似た分子であることから予想していた通り,FasリガンドはTNFに似た分子であった.TNFファミリーに属する分子は哺乳類では16種類知られている.未だその機能が十分解明されていないものもあるが,多くは細胞の増殖や分化,細胞死を制御することにより,主に造血系や免疫系の発生と機能に関与している.そのうちTNFα, lymphotoxinα, Fasリガンド, TRAIL (TNF-related apoptosis-inducing ligand), Apo3リガンドの5つが,強力な細胞死誘導作用をもつ,いわゆるデス因子である.中でもFasリガンドは専らアポトーシスを誘導するという意味で,デス因子のプロトタイプと言える.
2. FasとFasリガンドの構造とシグナル伝達
2-A. FasとFasリガンドの構造
FasはTNF受容体ファミリーに属するI型 (アミノ末端が細胞外に配向する) 膜貫通蛋白で,細胞外領域はこのファミリーに特徴的なシステインに富むコンパクトなドメイン構造の繰り返しからなる.Fasの細胞内領域とI型TNF受容体の細胞内領域に各々のアポトーシス誘導能に必須で,しかも両受容体間で共通したアミノ酸配列のモチーフが存在する領域が存在する.このモチーフはアポトーシスに関与する多くの分子中にも発見され,現在デスドメインと呼ばれる.
一方,Fasリガンドは,他のTNFファミリー分子 (lymphotoxinαを除く) 同様,II 型 (カルボキシル末端が細胞外に配向する) 膜貫通蛋白である.膜結合型TNFαはTNFα converting enzyme (TACE) と呼ばれる特異的な膜結合型メタロプロテアーゼによって切断され,可溶型に転換することが知られている.Fasリガンドも同様に未同定のメタロプロテアーゼにより切断され,可溶型に転換する(6).膜結合型に比べ、可溶型Fasリガンドはアポトーシス誘導能がかなり減弱する.特にマウス可溶型Fasリガンドはほとんどアポトーシス誘導能を失う.したがって,Fasリガンドの場合,可溶型への転換はFasリガンド活性の負の調節機構と考えられる(7).しかし,ヒト可溶型Fasリガンドは,細胞によってはアポトーシスを誘導するし,アポトーシス誘導以外の別の機能を果たす可能性も否定できない.Fasリガンドの細胞内領域はリガンドとしては長い約80アミノ酸からなる.また,著しくプロリンに富んだそのユニークな配列はマウスとヒトで良く保存されている.この領域はFasリガンドが一旦細胞内顆粒に留まり,刺激に応じて細胞表面に移動するために働いているらしい(8).
可溶型TNFαとTNF受容体の複合体は,エックス線結晶解析の結果から,リガンドが三量体を形成し,リガンド同士の接触面に形成される三つの溝に受容体が一つづつ結合した三対三の複合体であることが明らかになっている.コンピューターを用いた構造予測から,Fasリガンド-Fas複合体もTNF-TNF受容体複合体と類似した三次構造とる可能性が支持されている (図2).生化学的な検討からもヒト可溶型Fasリガンドは生理的な緩衝液中で三量体を形成していると考えられる.
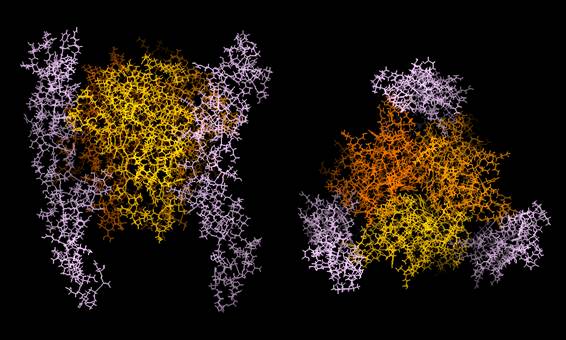
図2:Fas-Fasリガンド複合体の立体構造モデル
X-線結晶解析で明らかにされTNF-TNF受容体複合体の立体構造を参考に、コンピューターを用いて予想されたFas-Fasリガンド複合体の立体構造モデルである。Fasリガンドは黄色、橙色、褐色で、Fasはピンク色で示した。(持田製薬株式会社バイオサイエンス研究所、中村範夫博士より提供)
2-2. Fasの細胞内シグナル伝達機構の概要
いったんFasリガンドがFasに結合すると,早ければ1時間以内にアポトーシスに特徴的な変化が観察される.蛋白合成を阻害してもアポトーシスは抑制されず,むしろ促進される場合が多い.すなわち,Fasの細胞内シグナル伝達分子は構成的に発現していることになる.また,他の経路によるアポトーシスと同様,カスパーゼの活性化が必須のステップであり,カスパーゼより下流の現象は基本的に一般的なアポトーシス経路と共通であると考えられる.したがって,Fasのシグナル伝達経路を明らかにするには,Fasとカスパーゼをつなぐ分子を発見すればよいことになる.この目的は二つの方法で達成された.一つは既知の分子と相互作用する未知の分子のcDNAをクローニングする方法として急速に普及したyeast two hybrid 法を用いる方法である.すなわち,Fasのデスドメインをベイト(釣餌)にして,この領域に結合する蛋白、そしてその結合蛋白に結合する次の蛋白のcDNAがこの方法で相次いで釣り上げられた.もう一つは抗Fas抗体でFasを免疫沈降し,共沈する蛋白複合体 (Death Inducing Signaling Complex/DISCと呼ばれる)を二次元電気泳動で分離し,その微量蛋白のアミノ酸配列を最新の技術で決定するという方法であった.これらの方法で二種類の蛋白が発見された.一つはFasのデスドメインに直接結合し,それ自身もまたカルボキシル末端側の半分にデスドメインを持つFas-associating protein with death
domain (FADD)/mediator of receptor-induced toxicity (MORT)1である(9, 10).もう一つはFADD/MORT1を介してFasに会合するカスパーゼで,そのアミノ末端側にFADDのアミノ末端側と共通のアミノ酸モチーフ(Death effector Domain, DEDと呼ばれる)を2つもち,カルボキシル末端側にカスパーゼ の構造を持つことからFADD-like ICE (FLICE)またはMORT1-associated CED-3 homolog (MACH) と命名された(11, 12).ICEは初めて発見された哺乳類のカスパーゼ (カスパーゼ1)で,CDE-3はアポトーシスの実行に関わる蛋白として初めて同定された線虫のカスパーゼである.ちなみにFLICE/MACHは哺乳類のカスパーゼとしては8番目に発見されたのでカスパーゼ8とも呼ばれる.FasとFADDは互いのデスドメインを介して,FLICEとFADDは互いのDEDを介して結合する (注2).
Fasのシグナル伝達機構の概要は現在以下のように考えられる (図3)(11).Fasリガンドによる受容体の三量体化を引き金に,Fasの細胞内領域にFADDやFLICEが会合してDISCを形成する.カスパーゼ8は他のカスパーゼと同様,通常は不活性型のプロエンザイムとして存在しているが,DISCに取り込まれると自己消化あるいは近接したカスパーゼ8同士で切断されることにより活性化されるらしい.活性型カスパーゼ8はカスパーゼ3などの下流カスパーゼを活性化する.さらに下流カスパーゼは様々な細胞内蛋白を切断することにより活性化あるいは不活性化し,アポトーシスに特徴的な変化を引き起こし,細胞を死に至らしめると考えられる.I型TNF受容体もTNF receptor1-associated death domain protein (TRADD)を介してFADDに結合し,FLICEを活性化することにより細胞死を起こすと考えられている.
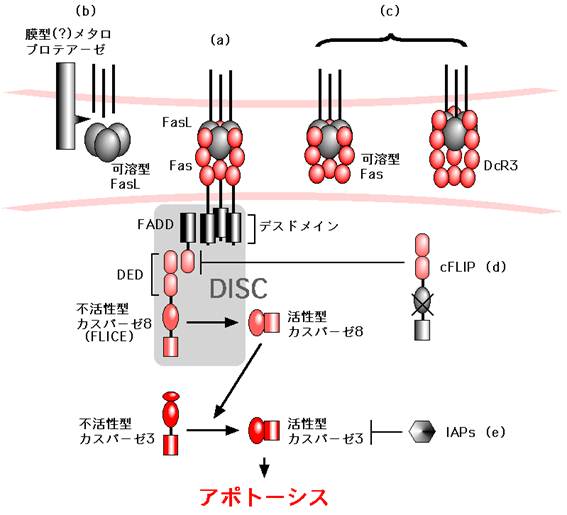
図3:Fasのシグナル伝達とその制御
(a) Fas-Fasリガンド系のシグナル伝達のフレームワーク (詳細は本文参照)
(b) - (e)
Fas-Fasリガンド系のシグナル伝達の抑制機構。(b), 未同定のメタロプロテーゼによるFasリガンドの切断はFasリガンド活性を減弱させる。(c), 可溶型Fasやおとり受容体 (DcR3)はFasリガンドと膜型Fasの結合を競合的に阻害する。(d), cFLIPはカスパーゼ8とFADDの結合を競合的に阻害する。(e), IAPファミリー分子はカスパーゼ3の活性化を阻害する。
このようにFasリガンドによるアポトーシスでは,受容体直下でカスパーゼの活性化が起こるので,Bcl-2ファミリーの制御を受けない場合がある. しかし,この直接的なカスパーゼの活性化がアポトーシスを誘導するに十分なレベルに達しないときは,カスパーゼ8がアポトーシス促進性Bcl-2ファミリーに属するBidを切断することによりBidのアポトーシス誘導能を高め,デスシグナルを増幅する回路があるらしい(13, 14).
この他にも、Fasのシグナル伝達に関与するとされる分子がいくつかあり、またFasの下流でセラミド,MAPキナーゼ,NF-kBなどのシグナル系が活性化されるという報告もあるが,未だコンセンサスにはなっていないのでここでは触れない.しかし,細胞によってはFasリガンドによる刺激でFADD-FLICE系以外のシグナルも活性化され,細胞の反応を修飾している可能性は考えられる.
2-3. Fas-Fasリガンド系の負の制御機構
Fasリガンドシグナルの負の制御機構もいくつか明らかになっている (図3).まず,前述のようにFasリガンドのメタロプロテアーゼによる切断がその一つに数えられる.TNF受容体ファミリーにはリガンドに結合するが,シグナルは伝えない"おとり"受容体がいくつか知られている.最近Fasリガンドに対するおとり受容体が発見された(15)。おとり受容体にはシグナルを伝える真の受容体に似たものもかなり違うものもあるが,Fasリガンドのおとり受容体DcR (decoy receptor) 3は後者に属する.DcR3は膜貫通領域のない可溶性の分泌蛋白で,FasとはTNF受容体ファミリーに属するという以上の類似性はない.しかし,競合的にFasリガンドに結合することにより,その活性を阻害する.mRNAのスプライシングの違いで生じる可溶型Fasも存在すると言われており、DcR3と同様の働きをする可能性がある。細胞内でFasシグナルを抑制する分子としては,cellular FLICE-inhibitory protein (cFLIP)が存在する(16).cFLIPはカスパーゼ8/FLICEと非常に良く似ていて,2つのDEDとカスパーゼ様領域を持つが、カスパーゼの活性中心に当たる部分が保存されておらず、カスパーゼとしての酵素活性は持たない。実はcFLIPより前に,ヘルペスウイルスなどの遺伝子に2つのDED領域からなるタンパクをコードするものが発見されていた。このウイルス遺伝子産物を細胞に発現させるとFADDへのFLICEの結合が妨げられると同時に,Fasリガンドや他のデス因子を介した細胞死も抑制されることから,viral FLICE-inhibitory proteins (vFLIP) と命名された(17).すなわち,デス因子シグナルの抑制はウイルスにとって有利に働くと考えられ,裏を返せばデス因子により宿主細胞にアポトーシスを誘導することが,ウイルス排除に有効な手段であると考えられる.cFLIPはアポトーシスを促進するという報告もあるが,基本的にはvFLIPと同様,FADDに結合することによりFADD-FLICEの結合を競合的に阻害し、デス因子シグナルの抑制に働くと考えられている.さらにIAP (inhibitor of apoptosis protein)
ファミリーの蛋白(ヒトではc-IAP1, cIAP2, XIAP, NIAPなど)はカスパーゼ3の活性化を抑制することによりデス因子経路に限らず、アポトーシス全般の阻害剤として作用する。IAPも元はウイルスのアポトーシス抑制因子として発見されたものである。この他、Fasのカルボキシル末端に結合するFas-associated phosphatase (FAP)-1と呼ばれる分子がアポトーシスを抑制すると言われているが、そのメカニズムは明らかでない。
3. Fas-Fasリガンド系の生理的・病理的役割
3-1. 免疫系のホメオスタシスと自己寛容における役割
lpr (lymphoproliferation) とgld (generalized
lymphoproliferative disease) と呼ばれる互いに良く似た異常を示す,しかしながら異なる遺伝子のマウス自然発生劣勢突然変異が知られている.lprやgld突然変異遺伝子のホモ接合体マウスは,生後2〜3ヶ月で,異常なTリンパ球の蓄積によるリンパ腫や脾腫を発症すると同時に,DNAや核蛋白,抗体などの自己成分に対する抗体、すなわち自己抗体が多量に産生し,自己免疫疾患を発症する.
長田博士らはマウスFasの遺伝子座が第19染色体上のlpr遺伝子座とほぼ同一の領域に存在することを発見し,lpr遺伝子はFas遺伝子の突然変異であることを明らかにした(図4)(17, 18).lprのFas遺伝子には第2イントロンにトランスポゾンの挿入があり,このため,正常なFasのmRNAがほとんど産生されなくなっていた.また,lprとほぼ同一の異常を示し,同じ遺伝子の突然変異として知られていたlprcgは,Fasのデスドメインに点突然変異があり, アポトーシス誘導能が誘導能がほとんど失われた突然変異であった.一方,マウスFasリガンドの遺伝子座を決定したところ,第1染色体のgld遺伝子座と不可分の位置にマップされた.さらに,gldのFasリガンドには一アミノ酸の置換を生じる点突然変異が存在し,このためにgld型のFasリガンドはアポトーシス誘導能を失っていることを発見した(19).つまり,gldはFasリガンド遺伝子の突然変異であった.
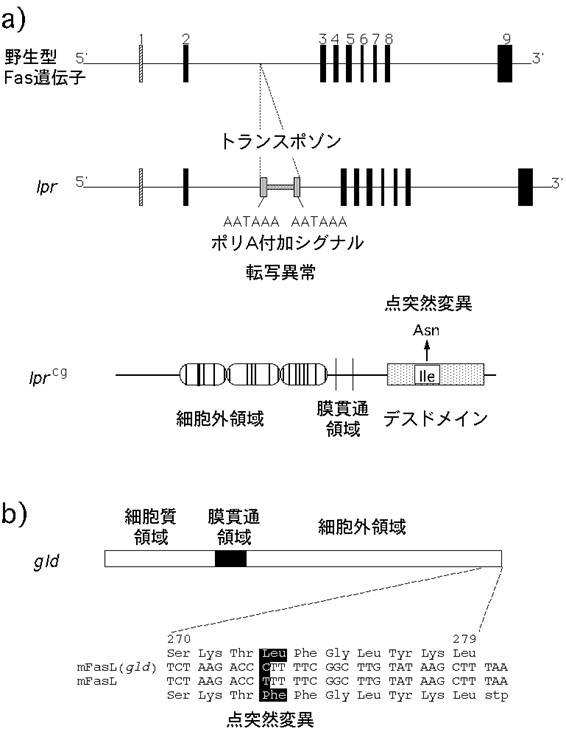
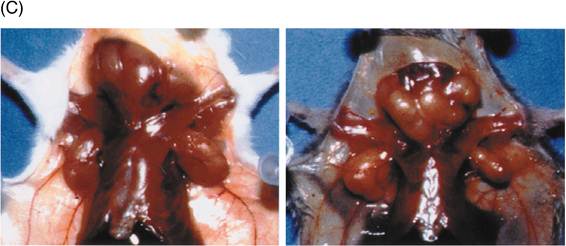
図4: lprとgld;FasとFasリガンドの自然発生突然変異
a, b) lpr (a)およびgld突然変異(b)の構造。詳細は本文参照。
c) lpr (写真左)やgld (右)のホモ接合体マウスは、異常な表面形質をもつT細胞が著しく増加し、リンパ腫を発症する。この異常T細胞の増殖性は弱く、死なないために蓄積している。また、自己抗体産生にもとづく全身性の自己免疫疾患を引き起こす。
lprやgldのリンパ節に蓄積している異常なT細胞の増殖性はむしろ弱く、死に難いことが原因で増加してしまうのである。したがって、Fas-Fasリガンド系はT細胞数のホメオスタシスに働いていると考えられる。T細胞やB細胞などのリンパ球は遺伝子再構成と言う特殊な方法で極めて多様性の高い抗原受容体を作り出す。この過程で、一部のT細胞やB細胞は自己の構成成分を抗原として認識する性質を獲得してしまう。このような自己反応性リンパ球は通常アポトーシスを起こして消滅したり、不活性化されることにより免疫学的自己寛容、すなわち免疫系が自己を傷害しないという性質が保たれている。Fas-Fasリガンド系が働かないと自己反応性リンパ球の排除が不完全になるために、自己免疫疾患を引き起こすと考えられる。
lprやgldマウスは全身性エリテマトーデスやリュウマチ関節炎などの自己免疫疾患のモデル動物として有名だったので,その原因遺伝子を特定したという発見は大きな反響を呼んだ.1995年に欧米の2つのグループが独立に,lprやgldマウスで観られる異常とよく似た症状を示す複数の自己免疫疾患の患者にFas遺伝子の突然変異を発見した(20, 21).FasとFasリガンドが,ヒトでも免疫系のホメオスタシスや自己寛容に重要な役割を果たしていることが明らかになったのである.
3-2. 細胞傷害性T細胞の細胞殺傷機構
細胞傷害性T細胞 (CTL)
はウイルスに感染した細胞や癌細胞を殺す能力を持つTリンパ球である.このCTLによる標的細胞の細胞死もアポトーシスである.CTLの細胞傷害分子機構としては,CTLの分泌顆粒の中に存在するCa++依存性に標的細胞の細胞膜に穴を開けるパーフォリン (perforin)
とこの穴から標的細胞に侵入してアポトーシスを誘導するグランザイム (granzyme) を介したものが知られていた.しかし,CTLはCa++非存在下でも標的細胞を殺す場合があること,CTLの細胞膜分画に細胞傷害活性があることから,CTLにはパーフォリン/グランザイム系以外にも細胞傷害機構が存在すると考えられていた.このCTLの第2の細胞傷害機構がFasリガンドにより担われていることが明らかになった(22).実際,パーフォリン遺伝子を破壊したマウスでも,ある程度のCTL活性が残存し,このマウスをgldマウスと交配し,パーフォリンも機能的Fasリガンドも持たないマウスを作製すると,通常の検査法ではCTL活性はほとんど検出されなくなる.
パーフォリンやグランザイムはCTLの分泌顆粒中に存在し,抗原受容体が標的細胞上の抗原を認識すると,標的細胞との接触面から脱顆粒により放出される.このため,パーフォリン/グランザイム系の細胞傷害は抗原特異性が非常に高い.一方,Fasリガンドによる細胞傷害も、(a) 抗原刺激でFasリガンドmRNAの発現が誘導される、(b) 分泌顆粒にプールされていたFasリガンドが抗原刺激で細胞表面に移動する、(c) 細胞表面に出現したFasリガンドは,メタロプロテアーゼにより細胞外領域が切断され活性が消失ないし減弱する、などの機構により基本的に抗原特異性を示す.しかし,活性化されたCTLはある程度Fasリガンドを細胞表面に発現し続けるため,感受性の高い細胞に対しては抗原非特異的な細胞傷害活性を示す可能性がある.
3-3. 炎症性疾患とFasリガンド
FasやFasリガンドが機能しないと自己免疫疾患になることは既に述べたが,我々はFasリガンドの働きが強すぎても病気になるのではないかと考えていた.というのは,Fasリガンドと同じような働きを持つマウスのFas蛋白に対する抗体を作成し,それをマウスに注射したところ,驚いたことに3時間以内に全てのマウスが死んでしまったからである.死んだマウスを調べてみると,肝臓がめちゃめちゃに破壊されていることが分かった.破壊された肝臓の組織像は劇症肝炎のそれに酷似しており,出血性ネクローシスと見られたが(図5a),細胞レベルで見ると死んだ肝細胞は明らかにアポトーシスの特徴を示していた(図5b).そこで我々は次のような仮説を立てた (図5c).肝細胞に肝炎ウイルスなどが感染すると,ウイルスを排除しようとして細胞傷害性T細胞が集まって来る.細胞傷害性T細胞はFasリガンドを発現してウイルスに感染した肝細胞を殺そうとする.適当にやっていればうまくウイルスを排除して事無きを得るのだが,細胞傷害性T細胞が増え過ぎたり,Fasリガンドを沢山作り過ぎたりすると,肝機能を維持できないほどに肝細胞を殺してしまうのではないか,それが劇症肝炎の発症機序ではないだろうか.
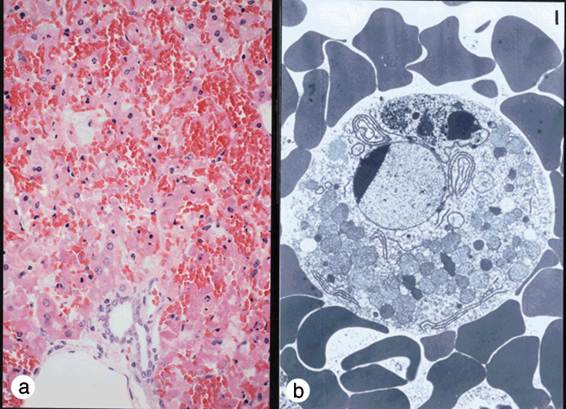
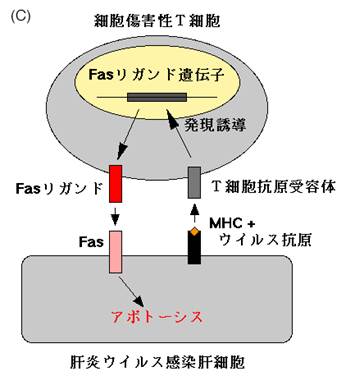
図5:Fasリガンドと類似の作用をもつ抗Fas抗体をマウスに投与すると、肝臓で激しい出血が起こり(a)、マウスは3時間程で死滅する。死んだ肝細胞を電子顕微鏡で観察すると、核の染色質の濃縮など明らかにアポトーシスの特徴を示していた(b)。ウイルス性劇症肝炎は本来ウイルスを排除するために働く細胞傷害性T細胞が暴走し、肝機能が保てないほどに肝細胞を傷害してしまうために起こるのではないかと考えられる(c)。
この仮説を検証するために,米国スクリプス研究所のFrancis V. Chisari博士にお願いして,劇症肝炎の動物モデルを提供していただいた.このモデルはB型肝炎ウイルスのS1抗原蛋白だけを肝臓に発現するトランスジェニックマウスに,S1抗原特異的な細胞傷害性T細胞を注入すると,劇症肝炎を発症して3日間ほどでマウスが死滅するというものである.マウスはたった一種類のウイルス蛋白を産生するだけで,ウイルスそのものを産生することはない.ウイルスを使わずにウイルス性劇症肝炎に近い状態を作りだせる素晴らしい動物モデルである.もし細胞傷害性T細胞がFasリガンドを使って劇症肝炎を引き起こしているとすれば,Fasリガンドの活性を中和できるFas-Fcを細胞傷害性T細胞と一緒に投与すれば,劇症肝炎の発症を抑えることが出来るはずである.このもくろみは見事に的中し,Fas-Fcを投与したマウスでは,肝炎発症が完全に抑えられた(23).この他,骨髄移植や臓器移植で問題となる移植片対宿主(GVH)病などに於ても,Fasリガンドが組織障害に関与している可能性があり,我々の作成したマウスFasリガンドに対する中和抗体は,マウスのGVH病モデルで一定の治療効果を示した(24).このほか,肺線維症やシェーグレン症候群などでもFasリガンドが関与していることが示唆されており,様々な炎症性疾患にFas-Fasリガンド系に抑制的に働く薬剤が有効である可能性がある.
3-4. Fasリガンドと炎症
眼,精巣などの組織では炎症が起こりにくいことから,免疫系の攻撃を特権的に免れる組織という意味で,免疫特権組織と呼ばれている.炎症は本来,侵入してきた異物やがん細胞を排除するための生体防御的反応ではあるが,過剰な炎症反応は往々にして自己組織を傷害し,機能障害を引き起こすため,これらの組織では炎症が起きにくい機構が発達したものと考えられる.最近,眼や精巣にはFasリガンドが発現しており,浸潤してきた炎症細胞にアポトーシスを誘導することによって炎症を抑制している可能性が示された(25, 26).実際,リンパ球や好中球などがFasリガンドに感受性を示し,自己反応性のリンパ球がFasリガンドにより排除されていると言う事実から,FasリガンドがCTLにではなく,組織側に発現していれば炎症抑制に働くということは合点が行く.ところが,遺伝子導入によってがん細胞や正常組織に異所性にFasリガンドを発現させると,むしろ好中球の激しい浸潤を伴う炎症が惹起されて、拒絶されたり組織破壊が起こることが見出された(27, 28).
我々もFasリガンドの免疫抑制作用を期待して研究を行い,逆にFasリガンドが炎症誘導することを見いだしていた.なぜFasリガンドは炎症を誘導するのだろうか.Fasリガンドはカスパーゼの活性化を介してアポトーシスを誘導することは既に述べたが,カスパーゼ1はもともと炎症性サイトカインであるIL-1βを不活性な前駆体から活性型に転換する酵素として知られていた.従って好中球などの様に前駆体IL-1βを発現している細胞にアポトーシスが誘導されれば,IL-1βが活性化し炎症を促進する可能性がある.実際,最近の我々の研究から,Fasリガンドを発現した癌細胞は,好中球に富む炎症性浸潤細胞にアポトーシスと同時に活性型IL-1βの放出を誘導し(注3),このIL-1βによって炎症がさらに増強されるらしいことが判明した(29).ミツバチは敵を刺すと毒針を根元の肉塊とともに自分の体から引きちぎり、敵の体に残す.そのため、そのハチは死ぬが、敵の体に残した毒針から攻撃フェロモンが出て,多くの仲間を呼び寄せて敵を撃退するのである.好中球はアポトーシスを起こして死ぬとIL-1βという攻撃ホルモンを出して,仲間を呼び寄せるのではないだろうか.低濃度の可溶型のFasリガンドが好中球にアポトーシスを誘導せずに,直接的に誘引物質として作用するという報告もある.しかし,我々の検討したところでは,少なくとも動物の体内ではその様な作用は認められなかった.
いずれにしろ,炎症性疾患におけるFasリガンドの病因的な作用も,Fasリガンドによる直接的な細胞傷害だけで説明されるのではなく,Fasリガンドの炎症誘導作用も重要な働きを果たしている可能性がある.なぜ免疫特権組織ではFasリガンンドの発現により炎症が抑えられるのかは不明であるが,免疫特権組織では,炎症細胞のアポトーシスによりIL-1βが放出されても,その活性を抑制するメカニズムがあるのかもしれない.Fasリガンドに状況に応じて炎症を抑制したり促進したりする作用があるのであれば,それをうまく制御することによって,様々な疾患の治療や,移植免疫の抑制というような新しい技術に役立てることが出来るかもしれない.
おわりに
Fasリガンドはデス因子の一つに過ぎないが,細胞の死を司ることにより予想以上に多彩な生命現象や病気と関わっていることが明らかになった.Fasリガンドと病気の関係に関しては非常に多くの研究報告が出てきており,これが一時の流行に留まらず,本当に有用な治療や診断に結びついてくれることを祈りながら研究している.最近明らかになったFasリガンドの炎症誘導作用も,おそらくFasリガンドが炎症細胞にアポトーシス誘導することを介してこの作用を発揮すると筆者らは考えている.一般には,アポトーシスは炎症を起こし難い細胞死とされているが,筆者にはアポトーシスと炎症にはもっと密接な相互作用がある様に思える.その辺からアポトーシスと炎症の関係を見直すと、また新しいバイオロジーが開けてくるかもしれない。筆者の研究に興味を持たれた方は是非我々のホームページhttp://web.kanazawa-u.ac.jp/~cdmtd/index.htmlを訪れて下さい。
文献
1. Yonehara,
S., Ishii, A., et al.: A cell-killing monoclonal antibody (anti-Fas) to a cell surface
antigen co-downregulated with the receptor of tumor necrosis factor. J. Exp.
Med. 169, 1747-1756, (1989)
2. Trauth, B. C., Klas, C.,
et al.: Monoclonal antibody-mediated tumor regression by induction of apoptosis.
Science 245, 301-305, (1989)
3. Itoh,
N., Yonehara, S., et al.: The polypeptide encoded by the cDNA for human cell surface
antigen Fas can mediate apoptosis. Cell 66, 233-243, (1991)
4. Rouvier,
E., Luciani, M.-F., et al.: Fas involvement in Ca2+-independent T cell-mediated
cytotoxicity. J. Exp. Med. 177, 195-200, (1993)
5. Suda, T., Takahashi,
T., et al.: Molecular cloning
and expression of the Fas ligand: a novel member of the tumor necrosis factor
family. Cell 75, 1169-1178, (1993)
6. Tanaka, M., Suda,
T., et al.: Fas ligand in human
serum. Nat. Med. 2, 317-322, (1996)
7. Suda,
T., Hashimoto, H., et al.: Membrane Fas ligand kills human peripheral blood T lymphocytes,
and soluble Fas ligand blocks the killing. J. Exp. Med. 186, 2045-2050, (1997)
8. Bossi,
G., and Griffiths, G. M.: Degranulation plays an essential part in regulating cell
surface expression of Fas ligand in T cells and natural killer cells. Nat. Med.
5, 90-96, (1999)
9. Chinnaiyan,
A. M., O'Rourke, K., et al.: FADD, a novel death domain-containing protein, interacts
with the death domain of Fas and initiates apoptosis. Cell 81, 505-512, (1995)
10. Boldin,
M. P., Varfolomeev, E. E., et al.: A novel protein that interacts with the death
domain of Fas/APO1 contains a sequence motif related to the death domain. J. Biol. Chem. 270, 7795-7798, (1995)
11. Muzio,
M., Chinnaiyan, A. M., et al.: FLICE, a novel FADD-homologous ICE/CED-3-like protease,
is recruited to the CD95 (Fas/Apo-1) death-inducing signaling complex. Cell 85,
817-827, (1996)
12. Boldin,
M. P., Goncharov, T. M., et al.: Involvement of MACH, a novel MORT1/FADD-interacting
protease, in Fas/Apo-1- and TNF receptor-induced cell death. Cell 85, 803-815, (1996)
13. Li,
H., Zhu, H., et al.: Cleavage of BID by caspase 8 mediates the mitochondrial damage
in the Fas pathway of apoptosis. Cell 94, 491-501, (1998)
14. Luo,
X., Budihardjo, I., et al.: Bid, a Bcl2 interacting protein, mediates cytochrome
c release from mitochondria in response to activation of cell surface death
receptors. Cell 94, 481-490, (1998)
15. Pitti,
R. M., Marsters, S. A., et al.: Genomic amplification of a decoy receptor for Fas
ligand in lung and colon cancer. Nature 396, 699-703, (1998)
16. Irmler,
M., Thome, M., et al.: Inhibition of death receptor signals by cellular FLIP. Nature
388, 190-195, (1997)
17. Watanabe-Fukunaga,
R., Brannan, C. I., et al.: Lymphoproliferation disorder in mice explained by defects
in Fas antigen that mediates apoptosis. Nature 356, 314-317, (1992)
18. Adachi,
M., Watanabe-Fukunaga, R., et al.: Aberrant transcription caused by the insertion
of an early transposable element in an intron of the Fas antigen gene of lpr mice. Proc. Natl. Acad. Sci. USA
90, 1756-1760, (1993)
19. Takahashi,
T., Tanaka, M., et al.: Generalized lymphoproliferative disease in mice, caused
by a point mutation in the Fas ligand. Cell 76, 969-976, (1994)
20. Fisher,
G. H., Rosenberg, F. J., et al.: Dominant interfering Fas gene mutations impair
apoptosis in a human autoimmune lymphoproliferative syndrome. Cell 81, 935-946,
(1995)
21. Rieux-Laucat,
F., Le, D. F., et al.: Mutations in Fas associated with human lymphoproliferative
syndrome and autoimmunity. Science 268, 1347-1349, (1995)
22. Berke,
G.: The CTL's kiss of death. Cell 8166, 9-12, (1995)
23. Kondo,
T., Suda, T., et al.: Essential roles of the Fas ligand in the development of hepatitis.
Nat Med. 3, 409-413, (1997)
24. Miwa,
K., Hashimoto, H., et al.: Therapeutic effect of an anti-Fas ligand mAb on lethal
graft-versus-host disease. Int. Immunol. 11, 925-931, (1999)
25. Bellgrau,
D., Gold, D., et al.: A role for CD95 ligand in preventing graft rejection. Nature
377, 630-632, (1995)
26. Griffith,
T. S., Brunner, T., et al.: Fas ligand-induced apoptosis as a mechanism of immune
privilege. Science 270, 1189-1192, (1995)
27. Allison,
J., Georgiou, H. M., et al.: Transgenic expression of CD95 ligand on islet beta
cells induces a granulocytic infiltration but does not confer immune privilege upon
islet allografts. Proc. Natl. Acad. Sci. USA 94, 3943-3947, (1997)
28. Seino,
K., Kayagaki, N., et al.: Antitumor effect of locally produced CD95 ligand. Nat.
Med. 3, 165-170, (1997)
29. Miwa,
K., Asano, M., et al.: Caspase 1-independent IL-1beta release and inflammation induced
by the apoptosis inducer Fas ligand. Nat. Med. 4, 1287-1292, (1998)
注1:我々が作製したFc融合蛋白作製用のプラスミドカセットは,3’端にスプライシングシグナルを付加した任意のcDNAをマルチクローニングサイトの中に挿入すると,スプライシングを起こしてFc部分とつながるように設計されており,様々なのFc融合分子を簡単に作れる.
注2:デスドメインやDEDはアポトーシスに関わる様々な分子内に発見されている.その他,デスドメインはankyrinやankyrinファミリーの蛋白の一部,およびIL-1受容体やLPS受容体の炎症シグナルの伝達分子であるMyD88にも存在する.デスドメインやDEDは70〜80アミノ酸に及ぶドメインであるが,それぞれのグループ内ですら,完全に共通するアミノ酸がほとんどない不明瞭なモチーフである.しかし,ある程度のギャップを許して並べるといくつかの共通した疎水性アミノ酸などが見られるほか,立体構造上6つのαヘリックスが良く似たトポロジーで配置されるらしい.立体構造的にはデスドメインとDED,さらにやはりアポトーシス関連分子に良く登場するcaspase recruitment domain (CARD)もグループを越えて似ていると言われている.これらの構造が,進化的にどのようにして現在の機能を獲得するようになってきたのか興味深い.
注3:不活性型のIL-1β前駆体を活性型に転換するにはカスパーゼ1が必須出あると考えられていた.しかし,興味深いことに,Fasリガンド刺激による活性型IL-1βの産生は,カスパーゼ阻害剤により抑制されるが,カスパーゼ1遺伝子を破壊したマウス由来の炎症細胞を用いても起こる.すなわち,カスパーゼ1非依存性にIL-1βを活性化しうるカスパーゼが存在すると考えられる.