�A�|�g�[�V�X�Ɖ��ǂ͐e�ʊW
(The
apoptosis is kin to the inflammation)
�{ �c �M �i
������w (2001) Vol.19 No.13
���� p198-205�@��2�� �זE���ƈ�w 3�j�Ɖu
�͂��߂�
�A�|�g�[�V�X�֘A�̐�����ǂނƁu�A�|�g�[�V�X�͉��ǂ�U�����Ȃ��זE���v�ƌ������Ƃ�������������ď�����Ă���B�����ߒ��̃v���O�����זE���Ȃǐ����I�ȍזE���̑������A�|�g�[�V�X�ł���A���̂悤�ȏꍇ���u�ɁA���ԁA���M���悤�Ȃ����鉊�ǂ��N�����Ă����̂ł͕s�s���ł��낤�B�܂��A�l�N���[�V�X(��)�ł̓v���e�A�[�[�Ȃǂ��܂ލזE���e�����R�o���A���͂̍זE�����Q������A���ǂ������N�������肷�邪�A�A�|�g�[�V�X���N�������זE�́A���e�����R�o����O���ÐH�זE����͂̍זE�ɋz������Ă��܂����߉��ǂ͗U�����Ȃ��Ƃ����Ă���B�����̂��Ƃ��A�|�g�[�V�X�Ɖ��ǂ̊W��r���I�ɂƂ炦���q�̃h�O�}���o���オ�������R���낤�B�����đ����̐l�̓��̒��ŃA�|�g�[�V�X�Ɖ��ǂ́u���l�̊W�v�ɂȂ��Ă��܂��Ă���悤�ł���B�Ƃ��낪�A��X�͍ŋ߃A�|�g�[�V�X�����ǂ�U�����邢�͑��i����ꍇ�����Ă��܂����B����͂������ȏł͂��邪�A�h�O�}�̈�[�����ꂽ���Ƃɂ͑��͂Ȃ��B���̋C�ōl����ƁA���̓A�|�g�[�V�X�Ɖ��ǂ̊Ԃɂ͐[〜���W�����邱�Ƃ������Ă���B�{�e�ł́A�悸���q�̃��x���ŃA�|�g�[�V�X�Ɖ��ǂ��e�ʊW�ɂ��邱�ƂS���Ă��������B���̏�ŁA�A�|�g�[�V�X�����ǂ�U������ꍇ�ɂ��ĉ�X�̌������ʂ𒆐S�ɉ������B
1. �A�|�g�[�V�X�Ɖ��ǂ̐[〜���W
1) ���ǂ��ĉ��H
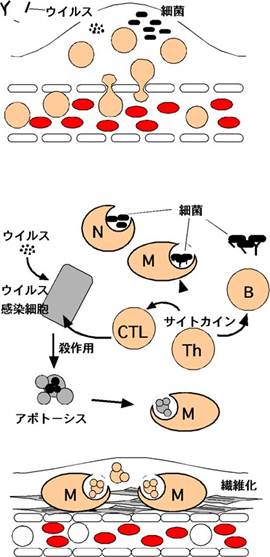
���ǂƂ������t�͈�w�ł͗ǂ��g���錾�t�ł��邪�A�Ɖu�w�I�ɂ͂��Ȃ肠���܂��Ȍ��t�ł���B�X�e�b�h�}���̈�w���T�ɂ��ƁA���ǂƂ́u�l�X�Ȉُ�h���ɂ�錌�Njy�їאڂ���g�D�ɋN����זE�w�I�A�g�D�w�I�����̓��I�ȕ����̂���Ȃ��{�I�ȕa���w��̉ߒ��v�ł���B�悭���ǂ̂S�咥�́u���ԁA�M���A��A�u�Ɂi�������Ԃ��M���ۂ��Ȃ�A�����u���悤�ɒɂނ��Ɓj�v�Ƃ���Ă��邪�A�ʏ퉊�ǂƌĂ����̂����̑S�Ă����킯�ł͂Ȃ��悤�ł���B����ɁA���ǂƂ����a�Ԑ����w�I�ȉߒ��ɂ́u�@�Ǖ������Ƃ��̌��ʋN����`�Ԋw�I�ω��A�A���������̔j�͏����A�B�C���Ǝ����̉ߒ����܂܂��v�Ƃ���Ă���i�}�P�j�B���̂��������A�̉ߒ��ł͖Ɖu�n���d�v�Ȗ������ʂ����Ă���B
|
�}�P�@���ǂ̌o�߂ƃA�|�g�[�V�X �@�Ǖ������Ƃ��̌��ʋN����`�Ԋw�I�ω��F�E�C���X��ۂȂǂٕ̈����N������ƁA�����F�����������p�����ÐH�זE������o����鉊�ǗU�����q�ɂ�茌�ǂ��g�����Ĕ��ԁA�M��������A���ǂ̓��ߐ������i���ğ��o�t�ɂ���������B�܂��A�������̑g�D�ւ̐Z�����N����B�A���������̔j�͏����F�Z�������w���p�[�s�זE�iTh�j�̓T�C�g�J�C�����Y�����A���̔�����������������BB�זE�͍R�̂��Y�����Ĉٕ����ÏW���A�D����(N)��}�N���t�@�[�W(M)�ɂ��ٕ����ÐH�𑣐i����B�זE���Q���s�זE(CTL)�̓E�C���X�����זE�ȂǂɃA�|�g�[�V�X��U������B�B�C���Ǝ����F�ٕ��̏������I���ƁA��ڂ����������̓A�|�g�[�V�X���N���B���������g�D�͏C������邪�A�������Ђǂ��Ƃ��͈ꕔ�͑@�ۉ������B�A�A�B�ɂ����ăA�|�g�[�V�X�זE�̓}�N���t�@�[�W�Ȃǂɂ�����ÐH�����B ���ǂ̃��[�r�[�փ����N(http://blip.tv/file/282053) |
|
2) ���ǂƃA�|�g�[�V�X�̕��q���x���ł̈ӊO�ɖ��ڂȊW
����ł́A�A�|�g�[�V�X�Ɖ��ǂ͖{���ɑ��l�̊W�Ȃ̂ł��낤���B���q���x���Ō���ƃA�|�g�[�V�X�Ɖ��ǂ́A���͐e�ʊW�ɂ��邱�Ƃ�������B�ȉ��ɂ��̎�����q�ׂ�B
2-i) �J�X�p�[�[�Ɖ��ǐ��T�C�g�J�C��
IL-1�ƌ����Α�\�I�ȉ��ǗU���T�C�g�J�C���ł���B���̈�ł���IL-1���͕s�����ȑO��̂Ƃ��ĎY������AIL-1�� converting enzyme
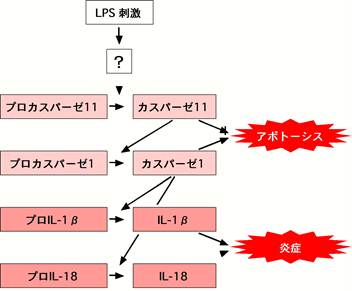
(ICE)�ɂ���đO��̃h���C�����ؒf����Ċ����^�ƂȂ�B�ʂ̉��NJ֘A�T�C�g�J�C���ł���IL-18�����l�̋@�\��ICE�ɂ�芈���������B�����ėǂ��m����悤�ɂ���ICE�����ŏ��ɔ������ꂽ�J�X�p�[�[�i�J�X�p�[�[1�j�ł���i�}�Q�j�B�J�X�p�[�[�̓A�|�g�[�V�X�̎��s�ߒ����i���Q�̃V�X�e�C���v���e�A�[�[�ł���i�J�X�p�[�[�̍��Q�Ɓj�B���ۂ�ICE/�J�X�p�[�[�P���ߏ蔭��������ƃA�|�g�[�V�X���U������邱�Ƃ�������Ă���(1)�B�J�X�p�[�[11���J�X�p�[�[1�̊����������IL-1����IL-18�̊������Ɋ֗^���Ă���(2)�B�����A�A�|�g�[�V�X���i��J�X�p�[�[�̈ꕔ����\�I�ȉ��ǐ��T�C�g�J�C���̊������𐧌䂵�Ă���̂ł���B���̂��Ƃ����ł����ǂƃA�|�g�[�V�X�̊Ԃɂ̓h�O�}�ɔ����Đ[���Ȃ��肪���邱�Ƃ��\�������B
|
|
�}�Q�@�J�X�p�[�[�Ɖ��� ���|�|���T�b�J���C�h(LPS)�ȂǂŎh������ƁA�J�X�p�[�[11�C�J�X�p�[�[1�����Ɋ���������A�����^�J�X�p�[�[�P�ɂ��IL-1����IL-18�Ȃǂ̉��ǐ��T�C�g�J�C���������������B�J�X�p�[�[�̃J�X�P�[�h�����̓A�|�g�[�V�X����łȂ��A���ǂł������Ă���̂ł���B |
2-ii) �A�|�g�[�V�X�Ɖ��ǗU���̃V�O�i���`�B�o�H�̗ގ���
�A�|�g�[�V�X�Ɖ��ǂ̕��q���x���ł̂Ȃ���͑��ɂ�����BTNF (tumor necrosis factor) �ƌĂ��T�C�g�J�C���̓A�|�g�[�V�X�U�����q�i=�f�X���q�j�ł���Ɠ����ɉ��ǐ��T�C�g�J�C���Ƃ��Ă��m����BTNF��e�̂ɂ�I �^��II �^�̓��ނ���A�O�҂���ɃA�|�g�[�V�X��U������҂����ǗU���Ɋ֗^����ƌ����Ă��邪�A���ۂ͂���قǒP���ł͂Ȃ��B�m����I �^TNF��e�̂�TNF�̃V�O�i�����A�|�g�[�V�X�U���V�O�i���ɕϊ�����T�^�I�ȃf�X��e�̂ł���B���̎�e�̂�TRADD, FADD�ƌĂ��A�_�v�^�[���q����ăJ�X�p�[�[8 �������������A�A�|�g�[�V�X��U������i�Č��̍e�Q�Ɓj�B�Ƃ��낪�ATRADD��RIP�ƌĂ��ʂ̃A�_�v�^�[���q�����NF-kB�̊��������U������BNF-kB�͏�q��IL-1��II �^TNF��e�̂̉����ł�����������A���ǗU���Ɋ֗^����ł��d�v�ȓ]�ʈ��q�ł���B������̎�e�̂���A�|�g�[�V�X�Ɖ��ǗU���̃V�O�i���������ɔ�������̂ł���i�}�R�j�B���l�̂��Ƃ�IL-1��e�̂�g���l��e�̂ł�������B�g���l��e�̂Ƃ̓��|�|���T�b�J���C�h�iLPS�j�ȂǕa���̂̐����ɑ���Z���T�[�Ƃ��ē����A���ǗU���Ɋւ��זE�\�ʕ��q�ł���B�����̎�e�̂�MyD88�AIRAK�ƌĂ��A�_�v�^�[���q�����NF-kB������������B�ʔ������ƂɁA�ŋ�MyD88��FADD����ăJ�X�p�[�[8�����������ăA�|�g�[�V�X��U�����邱�Ƃ����ꂽ(3)�B�}3�����Ă���������A��\�I�ȃA�|�g�[�V�X�U�����q�ł���TNF�Ƒ�\�I�ȉ��ǗU�����q�ł���IL-1�̃V�O�i���`�B�o�H�����ɗގ����Ă��邱�Ƃ��������肾�낤�B����ɁA���̐}�Ɏ����悤��MyD88, IRAK�͒P�ɋ@�\�I��TRADD, RIP�Ɏ��Ă���ƌ��������łȂ��A�f�X���q��e�̂�TRADD, FADD�ɑ��݂��A�f�X�h���C���ƌĂ��`�����q�Ԃ̌����Ɋ֗^���郂�W���[�������L���Ă���̂ł���B�����̎����͕��q�i���̊ϓ_���猩�āA�A�|�g�[�V�X�Ɖ��ǂ����ʂ̑c��I���q�o�H���琶�������Ƃ������ƍl������B�}�R�Ɏ����悤��NF-kB�̓A�|�g�[�V�X��}����������œ����B�������A����������ĉ��ǔ����̓A�|�g�[�V�X��}������ƍl����̂͒Z���I�ł���A�ނ��뉊�ǂƃA�|�g�[�V�X���ٖ��ɋ����������Ă���؋��ƍl����ׂ��ł͂Ȃ����낤���B
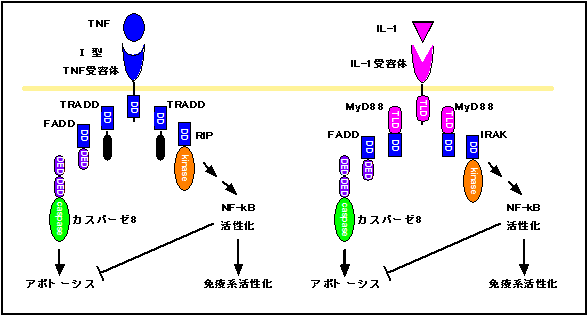
�}�R�@I�^TNF��e�̂�IL-1��e�̂̃V�O�i���`�B�o�H�̗ގ����B
�f�X��e�̂ł���I�^TNF��e�͍̂זE���Ƀf�X�h���C��(DD)�������ADD�����A�_�v�^�[���qTRADD�AFADD����ăJ�X�p�[�[8������������B�܂��ATRADD��DD�ƃL�i�[�[�h���C��������RIP����āANF-kB�̊��������U������B����A��\�I���ǐ��T�C�g�J�C���ł���IL-1�̎�e�͍̂זE����TIR�h���C���������ATIR��DD�����A�_�v�^�[���qMyD88�A����Ƀf�X�h���C���ƃL�i�[�[�h���C��������IRAK�����NF-kB������������B�܂��AMyD88��FADD �A�J�X�p�[�[�W����ăA�|�g�[�V�X��U��������Ƃ���������BIRAK��RIP�̃L�i�[�[�h���C����NF-kB�̊������ɂ͕s�v�ł���ƌ����Ă���BNF-kB�̊������͖Ɖu�@�\�̊�������U������Ɠ����ɃA�|�g�[�V�X��}������ƍl�����Ă���BDED�̓f�X�G�t�F�N�^�[�h���C���B
�ŋߒ������Apaf (apoptotic protease activating
factor)-1��Ced-4�Ƒ����̃h���C���\�������V�K�q�g�`����Nod1�ANod2�������BApaf-1�̓A�|�g�[�V�X���N���Ă���זE�̍זE���ɑ��݂��A�J�X�p�[�[�R�̊�������U������Apaf�̃R���|�[�l���g�Ƃ��Ĕ�������A�����̃A�|�g�[�V�X���s���q�̈��Ced-�S�̚M�������ɂ�����z�����O�ƌ����镪�q�ł�����B���������t��������ƁAApaf-1�̓A�|�g�[�V�X�̉ߒ��Ń~�g�R���h���A������o���ꂽ�`�g�N���[��c�Ƃ̌������_�@�ɁA�J�X�p�[�[�X�Ɍ������Ă�������������镪�q�ł���BNod1�ANod2���q��Apaf-1���l�J�X�p�[�[�X�Ɍ������ăA�|�g�[�V�X��U������Ɠ�����NF-kB�̊�������U�������p������炵���B����ɖʔ������Ƃ�Nod1�ANod2�͍ې����ł���LPS�Ɍ������A���̌��ʂƂ���NF-kB������������B�����̕��q���ۊ����ɂ�鉊�ǂɏd�v�ȓ��������Ă���Ƃ���A�g���l��e�̂̔����ƕ��ԑ唭���ł���Ɠ����ɁA�A�|�g�[�V�X�Ɖ��ǂ̃V�O�i���`�B�o�H�̗ގ����������D��̈�ƍl������B
�@���̂悤�ɁA�A�|�g�[�V�X�Ɖ��ǂ͕��q���x���Ō���Ɛe�ʊW�ɂ���A�i���I�ɖ��ڂȊW�����邱�ƂɋC�Â��B
3) �A�|�g�[�V�X�Ɖ��ǂ͋@�\�I�ɂ��W���[���B
�u���ǂ��ĉ��H�v�̍��ŏq�ׂ��悤�ɉ��ǔ����̖ړI�͑g�D�����Q����ٕ���j��E�������A�������C�����邱�Ƃł���B���ٕ̈��ɂ̓E�C���X�≻�w�����Ȃǂɂ��C���ňٕ������ꂽ���ȍזE���܂܂��B����A�|�g�[�V�X�͕s�v�ɂȂ������ȍזE��ٕ������ꂽ�זE��r������@�\�ł���B�����l����Ɖ��ǂƃA�|�g�[�V�X�̖ړI�͈ꕔ�d�����Ă���A�A�|�g�[�V�X�Ɖ��ǂ����ڂȊ֘A�������Đi�����Ă������̂ł���Ƃ����l���ɂ��Ȃ����邾�낤�B�܂��A���ǍזE(�D�����⊈�����}�N���t�@�[�W�j�����o���銈���_�f�Ȃǂ̍זE���Q���q�A�זE���Q���s�זE�Ȃǂ��Y������f�X���q�i�A�|�g�[�V�X�U���T�C�g�J�C���j�͕W�I�זE�ɃA�|�g�[�V�X��U�����邵�A���ǂ̏I�����ɂ͕s�v�ɂȂ������ǍזE���A�|�g�[�V�X���N���ď��ł��Ă����B�]���āA���Ȃ��Ƃ����ǂ̉ߒ��ł̓A�|�g�[�V�X���p�ɂɋN�����Ă���B�A�|�g�[�V�X���N�����זE���ÐH�זE�ɂ���Ĕr������Ȃ���Ȃ�Ȃ����A���̃X�e�b�v�͉��ǂɓ��L�̂��Ƃł͂Ȃ��A�A�|�g�[�V�X��ʂɂ��Ă����l�����Ă���B����ɁA�A�|�g�[�V�X�����ǂ𑣐i���邱�Ƃ�����B����ɂ��Ď��̍��ŏڂ����q�ׂ�B
2. Fas���K���h������A�|�g�[�V�X�Ɖ���
���҂��A�|�g�[�V�X�Ɖ��ǂ̊W�ɊS�������n�߂��̂́A��X���������Ă���Fas���K���h�Ɩ��t�����A�|�g�[�V�X�U�����q���A���ǗU����p�������Ƃ����炩�ɂȂ������Ƃ���ł���B�����Ō㔼�́AFas���K���h�̃A�|�g�[�V�X�U����p�Ɖ��ǗU����p�̊W�ɂ��ďq�ׂ����B
1) Fas���K���h���ĉ��H
�@Fas���K���h��TNF�t�@�~���[�ɑ�����f�X���q�̈��ŁA�W�I�זE��̎�e��Fas�Ɍ������邱�Ƃɂ��A�W�I�זE�ɃA�|�g�[�V�X��U������(4)�BTNF�����l�A�������^�T�C�g�J�C���Ƃ��ĎY������邪�A���^���v���e�A�[�[�ɂ��v���Z�V���O����Ɖn�^�ɓ]������B�A�|�g�[�V�X�U�������͎�ɖ��^���S���A�q�g�n�^Fas���K���h�͂�����x�A�|�g�[�V�X�U���������������A�}�E�X�̉n�^Fas���K���h�͂قƂ�ǂ��̊����������Ȃ��B�R���Ŋ��������ꂽ�s�זE�Ȃǂɔ������A�זE���Q���s�זE���E�C���X�����זE����זE�ɃA�|�g�[�V�X��U�����邽�߂̃G�t�F�N�^�[���q�Ƃ��ē����Ă���B�܂��A�s�זE���ɉ�����Fas���K���h�Ɋ��������A���Ɋ������s�זE�͎��g�̔�������Fas���K���h�ł܂��Ɏ��E���邱�Ƃɂ���Ă��̐����R���g���[������Ă���B���̂��߁AFas��Fas���K���h�̓ˑR�ψك}�E�X�́A�s�זE�̐����ُ�ɑ�������B�܂������̓ˑR�ψك}�E�X�͎��ȍR�̂��Y����SLE�^�̎��ȖƉu�����ǂ���B���̂��Ƃ���Fas���K���h�͎��Ȕ������s�זE��B�זE�̏����Ɋ֗^���Ă��邱�Ƃ����炩�ɂȂ��Ă���B
2) Fas���K���h�ƖƉu����
��A�����͌Â����牊�ǂ��N�����ɂ����g�D (�Ɖu�����g�D) �Ƃ��Ēm��Ă���B�����̑g�D�ɂ�Fas���K���h���������Ă���A�Z�����Ă��鉊�ǍזE��Ԃ蓢���ɂ��Ă��܂����Ƃʼn��ǂɂ��d�x�̋@�\��Q�������Ă���ƍl�����Ă���(5,6)�B���̍l���W������ƁA�ڐA�g�D��Fas���K���h�������Ă����A���┽�����}���ł���\�����l�����A���̂悤�Ȏ��݂��Ȃ���Ă���B�܂��A����g�D��Fas���K���h���������Ă���A����זE���Ɖu�n�̍U������������̎�i�Ƃ���Fas���K���h�𗘗p���Ă���\�����������������(7)�B�������A�M�҂̒m�������ۂ�Fas���K���h���������זE�����̓��ŖƉu��}�����AFas���K���h����ᇌ`���ɗL���ɓ����Ă���Ƃ��������I�ȍ����͖R�����B
3) Fas���K���h�ɂ�鉊�ǂ̗U��
�������s�זE��Fas���K���h�Ɋ����������Ƃ���AFas���K���h���Ɖu��}������\���ɂ��ẮA��X���������Ă����B�啪�ȑO�̂��Ƃł��邪�A��X�͓��n�}�E�X�ɈڐA����Ƃ�������͎�ᇂ��`�����邪�A�s�זE�ˑ����̖Ɖu�ɂ��3�T�Ԃقǂŋ��₳��邪��זE�ɐl�H�I��Fas���K���h�������A���₪�x�����邩���������B����ƁA�\�z�ɔ����Ă���זE�̋���͂ނ��둣�i����Ă��܂��A��X�̎����͂����ŒI�グ�ɂȂ��Ă����B���̌�A��q�̂悤��Fas���K���h���Ɖu�����Ɋ֗^���Ă���Ƃ������Ȃ���A����Ђ˂��Ă����B�Ȃ�Fas���K���h��������זE�͋��₪���i���ꂽ�̂��A���̓����͐����ɂ���Ė��炩�ɂ��ꂽ�B�ނ��Fas���K���h����������זE�͍D�����̐Z�������ǂ�U�����A����ɂ���ċ��₳��邱�Ƃ��������̂ł���(8)�B��X��Fas���K���h�����������זE���}�E�X���o�ɈڐA����ƁA�\�����Ԃ̂����ɕ��o���ɍD�������Z�����Ă��邱�Ƃ�F�߂��i�}�S�j�BFas���K���h��`�q���g�����X�W�F�j�b�N�}�E�X�̎�@��A�f�m�E�C���X�x�N�^�[��p�������@�ł������ɔ���������ƁA��͂苭���D�����̐Z�����N����A�g�D���j���ƕ���Ă���(9,10)�B�����̂��Ƃ���AFas���K���h�ɂ͉��ǂ�U�������p�����邱�Ƃ����炩�ɂȂ����B
|
|
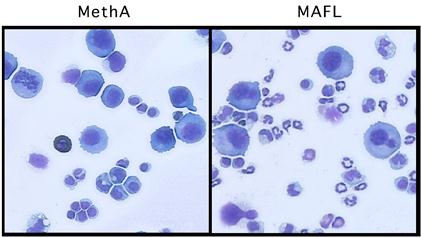
�}4�@Fas���K���h�ɂ�鉊�ǗU�� Fas���K���h��`�q����������זE��(MAFL)�n�}�E�X�̕��o�ɈڐA����ƁA�ΏƂ���זE��(MethA)���ڐA�����Ƃ��ɔ�ׁA�������D�����̐Z�����U�������B |
Fas���K���h�̉��ǗU����p�̕��q�@�\
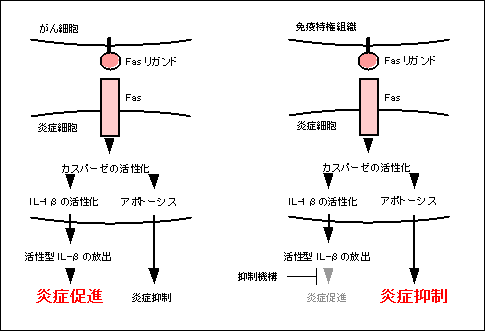
Fas���K���h�͉��ǂ�U��������}�������肷��ƌ����͈ꌩ�������Ă��邪�A�����̌��ʂ�I�ɐ������邱�Ƃ͕s�\���낤���B�����ʼn�X�͈�̉����𗧂Ă��i�}5�j�BFas���K���h�̓J�X�p�[�[�̊���������ăA�|�g�[�V�X��U������B�܂��A�O�q�̂悤�ɃJ�X�y�[�X1��IL-1���������^�ɓ]������y�f�ł���B�Ƃ���A�O���IL-1�������Ă��鉊�ǍזE�i�D������}�N���t�@�[�W�j��Fas���K���h����p������A�A�|�g�[�V�X���U�����ꉊ�ǍזE�͎��ʂ��A�����ɃJ�X�p�[�[�P������������Ċ����^IL-1�����Y������A����ɂ���ĉ��ǂ����i�����̂ł͂Ȃ����ƍl�����̂ł���B���ǍזE�̃A�|�g�[�V�X�ɂ�鎀���A����ɂ����ǂ𑣐i����Ƃ����l���ł���B�����Ă����A����g�D��Fas���K���h�Ɠ����ɉ��ǐ��T�C�g�J�C���̊�����}�����鉽�炩�̕��q���������Ă�����A���ǍזE��Fas���K���h�ŎE����A�����ʼn��ǂ͏I�����Ă��܂��B�܂�Ɖu������Ԃ���������̂ł͂Ȃ����B
���̉����������邽�߁A�܂��O�q�̂���זE���}�E�X�̕��o�ɈڐA��������ŕ��o���t����IL-1�����ʂ����Ƃ���A�m����Fas���K���h������������זE���ڐA�����Ƃ��̂�IL-1�������o���ꂽ(11)�B����ɍD�����ɕx�މ��ǐ��Z���זE��Fas���K���h�̑��݉���18���Ԕ|�{�����Ƃ���A���ǍזE�ɃA�|�g�[�V�X���U�������Ɠ����Ɋ����^IL-1���̕��o���F�߂�ꂽ�BFas���K���h�̕ς��ɃX�^�E���X�|�����ƌ�����܂ŃA�|�g�[�V�X��U�������ꍇ�ɂ������^IL-1���̕��o���U�����ꂽ�B�Ƃ��낪�A�D�����͎����̒Z���זE�ŁA18���Ԕ|�{����Ή��̎h���������Ȃ��Ă�40���ʂ̍זE�̓A�|�g�[�V�X���N���̂ł��邪�A���̏ꍇ��IL-1���̕��o�͋N����Ȃ��B�܂�A�v���O�����זE���̂悤�Ȏ��R�ȃA�|�g�[�V�X�ł�IL-1���͕��o���ꂸ�AFas���K���h���܂ŋ����A�|�g�[�V�X��U�������Ƃ��̂�IL-1�������o�����̂ł���BFas���K���h�̉��ǗU����p��IL-1���֗^���Ă��邱�Ƃ��m�F���邽�߁AIL-1��`�q�̃m�b�N�A�E�g�}�E�X�̕��o��Fas���K���h��������זE�𓊗^�����Ƃ���A�D�����̐Z���������ɒቺ�����B�����̌��ʂ����X�̉����̔����͂قڐ��������Ƃ������ꂽ�B�ЂƂ����ƈ�����̂́AFas���K���h�h���ɂ��IL-1���̎Y���́A�J�X�p�[�[�j�Q�܂ɂ��}������邪�A�J�X�p�[�[1��`�q��j���}�E�X�R���̉��ǍזE��p���Ă��N�������Ƃł���B�J�X�p�[�[�P�ȊO�ɂ��������̃Z�����v���e�A�[�[��IL-1���������������邱�Ƃ͒m���Ă������A�J�X�p�[�[�P�����}�E�X��LPS�h���ɂ��IL-1���̊��������قƂ�nj����Ȃ����Ƃ���A���ۂɂ͐��J�X�p�[�[�P��IL-1���̊�������S���ƍl�����Ă����B�]���āA��X�̒m���͐��̓��ŃJ�X�p�[�[�P��ˑ�����(�A���A���炩�̃J�X�p�[�[�Ɉˑ�����)IL-1���������������邱�Ƃ��������Ƃ����Ӗ��ł��ŏ��̗�ł��낤�B���̌�APropionibacterium acnes�Ŋ����������}�N���t�@�[�W��Fas���K���h�Ŏh������ƃJ�X�p�[�[�P��ˑ�����IL-18�������^�ɓ]������ĕ��傳���ƌ������Ȃ���Ă���(12)�B
|
�}5�@Fas���K���h�ɂ�鉊�ǂ̑��i�Ɨ}���̃��J�j�Y���i���f���j Fas���K���h�͍D������}�N���t�@�[�W �Ȃǂ̉��ǍזE�ɍ�p����ƁA�J�X�p�[�[�̊���������āA�A�|�g�[�V�X�Ɖ��ǐ��T�C�g�J�C���̊��������ɗU������B���̌��ʁA���̉��ǍזE�͎���ł��A����ɋ������ǍזE�̐Z�����U������Ă��܂��B�������A���ǐ��T�C�g�J�C���̍�p���}�������悤�Ȋ������݂���ꍇ�ɂ́A���ǍזE�����ʂ��Ƃɂ�艊�Ǘ}���ɍ�p����ƍl�������B |
��X��Fas���K���h�����̓��ʼn��ǂ�U������ߒ����ȉ��̂悤�ɍl���Ă���BFas���K���h������זE��g�D�Ɉُ����ɔ�������ƁA�ʏ�̏�Ԃő̒����Ď����ď��Ă���A�����͎ア���ǔ����ŏW�܂����D�����Ȃǂ����̏�ŃA�|�g�[�V�X���N�����A�����^��IL-1������o���ĉ��ǂ�U���A���i����̂ł͂Ȃ����낤���B�������AIL-1�����������}�E�X�ł��A������xFas���K���h�h���ɂ��D�����̐Z���͋N���邵�AFas���K���h��������זE���������₳���X�����ς��Ȃ��B�����̂��Ƃ����X�́AIL-1�ȊO�ɂ�Fas���K���h�h���ɂ��U������鉊�ǗU�����q�����݂���ƍl���A���̓�������݂Ă���B�����(13)��Ottonello��(14)�͉n�^��Fas���K���h���D�����ɑ��|�{��̒��ő��������q�Ƃ��ē����ƕ��Ă��邪�A���̓��Ō�����Fas���K���h�̍D�����Z���U���������ᇋ��④�i��p�͖��^Fas���K���h�ɒS���Ă���A�n�^Fas���K���h�ɂ͂��̂悤�Ȋ����͂Ȃ�����(15,16)�B
�Ƃ���ŁA��X�̉����̎c��̔����A���Ȃ킿�u�Ɖu�����g�D�ł͂Ȃ�Fas���K���h�ɂ�艊�ǂ����i���ꂸ�ɋt�ɗ}�������̂��v�ɂ��ẮA���̕��q�@�\�̏ڍׂ͖����s���ł���B�������A��ł�IL-1���Z�v�^�[�A���^�S�j�X�g(IL-1ra)���P��I�ɔ������Ă��邱�Ƃ�����Ă���B�܂��AFas���K���h������������זE�ɉ��Ǘ}����p����TGF�����ɔ���������ƁAFas���K���h�̉��ǗU����p���L�����Z�������ƌ���������B�]���ď�q�̂悤�ɁAFas���K���h�ɂ��D�����Ȃǂ̉��ǍזE���A�|�g�[�V�X���N���AIL-1�������o����Ă��A���̍�p����������Ȃ��l�ȏ������ɑ��݂���AFas���K���h�͊������s�זE���܂މ��ǍזE���E���������A���Ǘ}���̕����ɓ����ƍl������B
4. ���ǐ�������Fas���K���h
��ɓ������f����p������������AFas���K���h�͌��NJ̉���ڐA�БΏh��a�ȂǁA���ǐ��̑g�D��Q���a�Ԃ��`������l�X�Ȏ����Ɋ֗^���Ă��邱�Ƃ����炩�ɂȂ��Ă���(17,18)�B��X�͓����A�זE���Q���s�זE�Ȃǂ�Fas���K���h���g���Ē��ړI�ɃA�|�g�[�V�X��U�����邱�Ƃ��g�D���Q�̎�Ȍ����ƍl���Ă����B�������A�̑��̂悤��Fas���K���h�ɂ�苭���A�|�g�[�V�X���U�������g�D����łȂ��A�l�X�ȑg�D�̉��ǐ�������Fas���K���h���֗^���Ă��邱�Ƃ���AFas���K���h�̉��ǗU����p�������̎����ŏd�v�Ȗ������ʂ����Ă���ƍl���Ă���B�܂��A�������f���ł̘b�ł��邪�AFas���K���h�̊����𒆘a����Fas-Fc�Z���`����RFas���K���h�R�̂Ȃǂ���X�̉��ǐ������̎��ÂɌ��ʂ������Ă��邱�Ƃ���A���������̎����ɑ���V�������Ö@�ɔ��W���邱�Ƃ����҂��Ă���B
������
�A�|�g�[�V�X�Ɖ��ǂ̓h�O�}�e�B�b�N�Ɍ�����悤�ɒP���ɔr���I�ȊW�ł͂Ȃ����Ƃ������Ă����������ł��낤���B�A�|�g�[�V�X�̌��ʂƂ��ĉ��ǂ����i�����ꍇ���炠��B��������X���������̂�"�זE���ɉ��ǐ��T�C�g�J�C������������ǍזE�ɃA�|�g�[�V�X��U�������ꍇ"�ƌ�������ȃP�[�X�ł͂��邪�A�A�|�g�[�V�X�Ɖ��ǂ��ٖ��ȘA�g���Ă��邱�Ƃ������זE�A�̃��x���ł̏؋����������ƌ����Ӗ��ł͏d�v�Ȕ������Ǝv���B�u�A�|�g�[�V�X�Ɖ��ǂ͐e�ʊW�v�Ƃ����ϓ_���炱���̌��ۂ����Ȃ����ƁA���q�A�זE�A�̂̃��x���ŐF�X�ƐV�����ǖʂ������Ă��邩���m��Ȃ��B
����
1. Miura, M., et al. : Cell, 75: 653-660,
1993
2. Wang, S., et al. : Cell, 92: 501-509, 1998
3. Aliprantis, A.
O., et al. : Embo J., 19: 3325-3336., 2000
4. Nagata, S., and Suda, T. : Immunol. Today, 16: 39-43, 1995
5. Bellgrau, D.,
et al. : Nature, 377: 630-632, 1995
6. Griffith, T. S., et al. : Science, 270:
1189-1192, 1995
7.
O'Connell,
J., et al. : Ann. N. Y. Acad. Sci., 910: 178-195, 2000
8.
Seino, K., et al. : Nat. Med., 3:165-170, 1997
9. Allison, J., et al. : Proc. Natl. Acad.
Sci. USA., 94: 3943-3947, 1997
10. Kang, S. M., et al. : Nat. Med., 3: 738-743, 1997
11. Miwa, K., et al. : Nat. Med., 4: 1287-1292, 1998
12. Tsutsui, H., et al. : Immunity, 11: 359-367., 1999
13. Seino, K., et al. : J. Immunol., 161: 4484-4488, 1998
14. Ottonello, L., et al. : J. Immunol., 162: 3601-3606,
1999
15. Hohlbaum, A. M., et al. :
J. Exp. Med., 191: 1209-1220, 2000
16. Shudo, K., et al. : Eur. J. Immunol., in press,
2001
17. Kondo, T., et al. : Nat. Med., 3: 409-413, 1997
18. Miwa, K., et al. : Int. Immunol.,
11: 925-931, 1999
����
ICE; IL-1��
converting enzyme
TNF;
tumor necrosis factor
TRADD;
TNF receptor 1-associated death domain protein
FADD; Fas-associating
protein with death domain
RIP;
receptor interacting protein
MyD88;
myeloid differentiation factor 88
IRAK; IL-1
receptor-associated kinase
NF-kB; nuclear factor kappa B