パイロトーシス:新しいネクローシス様プログラム細胞死
医学のあゆみ 2013, 246:432-437
サマリー
細胞内寄生細菌などはマクロファージによる貪食を誘導し、マクロファージに寄生して、宿主内での増殖、拡散に利用する。一方、マクロファージは病原体に感染するとIL-1βやIL-18などの炎症性サイトカインを放出して周囲の細胞に危険を知らせると同時に、パイロトーシスと呼ばれる速やかな細胞膜の崩壊を伴うプログラム細胞死を起こすことで、細菌の増殖の場となっている自らを消去する。IL-1βやIL-18の分泌とパイロトーシスはいずれもカスパーゼ1依存性の応答で、カスパーゼ1の活性化はインフラマソームと呼ばれるアポトソームと類似の複合体の形成によって誘導される。したがって、マクロファージのこれらの応答は一体として起きるように仕組まれており、そのことが感染防御に寄与していると考えられる。
はじめに
様々な細菌やウイルスがマクロファージにネクローシス様の細胞死を引き起こす。ネクローシスは一般に受動的な細胞死と考えられていたが、近年、この細胞死はカスパーゼ1依存性のプログラム細胞死であることが明らかになった。この細胞死に際し、マクロファージはIL-1βやIL-18 などの炎症性サイトカインを放出する。カスパーゼ1はこれらのサイトカインを前駆体型から成熟型に転換する蛋白質分解酵素でもあることから、これら2つの事象(細胞死とサイトカインの放出)は協調して起きるように仕組まれていると考えられる。Cooksonらは、この細胞死が形態的にアポトーシスとは明らかに異なる特徴を示すこと、本質的に炎症を誘導するようにプログラムされた細胞死であることなどから、この細胞死を、「熱または炎」の意で炎症を象徴するpyroと「落ちる」の意で合目的な死を象徴するptosis(apoptosisの語尾と同じ)という2つのギリシャ語の語根をつなげ、pyroptosis(パイロトーシス、サイドメモ参照)と命名した[1, 2]。本稿では、パイロトーシスの分子機構や生理的意義について概説し、インフラマソームの下流でこれらの応答が協調して起こることの意義について考察する。
1. パイロトーシスとは
パイロトーシス研究の歴史が比較的浅いこともあり、パイロトーシスの厳密な定義が定まっているとはいえない。おそらく、研究の進展とともに多少ともその定義は変遷していくことになると思うが、現時点でパイロトーシスと呼ばれている細胞死の特徴を述べてみる。
命名者であるCooksonら[1-3]は、サルモネラ菌感染によるマクロファージの細胞死を詳細に検討し、先ず分子メカニズムについて、明確にパイロトーシスはカスパーゼ1依存の細胞死であるとしている。最近、カスパーゼ11がカスパーゼ1とは独立に細菌感染によるマクロファージの細胞死を誘導することが発見され(後述)、この細胞死にもパイロトーシスという言葉が用いられているが、この呼称の妥当性は今後議論になると思われる。形態的、生化学的特徴としては、(1)速やかな細胞膜のバリア機能の喪失による細胞の膨潤・破裂が認められること、(2)染色体DNAはある程度断片化され(TUNEL陽性になる)が、DNAのヌクレオソーム単位の断片化は認められず、核の形態変化も乏しいこと、(3)カスパーゼ3の活性化は起こらないとなどを挙げている[3]。(1)の特徴については、他の実験系でもパイロトーシスの重要な指標になっているが、その他の特徴については必ずしも検証されておらず、パイロトーシスの定義に含められるか否かは不明である。加えて、炎症誘導性の細胞死であることはパイロトーシスの名称の由来でもあり、重要な特徴である。カスパーゼ1はIL-1βやIL-18を活性型に転換する酵素であり、実際にマクロファージのパイロトーシスは通常IL-1βやIL-18 の産生を伴うことから、これらのサイトカインの産生をパイロトーシスの定義の一つと考える研究者もいる。しかし、パイロトーシスでは細胞膜の崩壊によって死細胞由来の自然免疫活性化物質(Damage-associated molecular patterns、DAMPs、サイドメモ参照)を放出するため、IL-1βやIL-18 の産生はパイロトーシスが炎症誘導性であるために必須とは言えない。また、カスパーゼ1を発現するがIL-1βやIL-18を発現しない細胞も存在し、Cooksonら[2]も神経や心筋のカスパーゼ1依存性細胞死がパイロトーシスに含まれる可能性を指摘していることから、現時点でIL-1βやIL-18 の産生をパイロトーシスの定義に含めるのは妥当でないと思われる。今後のパイロトーシス研究の広がりも考慮すると、現状では「パイロトーシスはカスパーゼ1依存性で速やかな細胞の膨潤・破裂を呈する炎症誘導性プログラム細胞死」とするのが妥当ではないだろうか。
パイロトーシスの分子機構
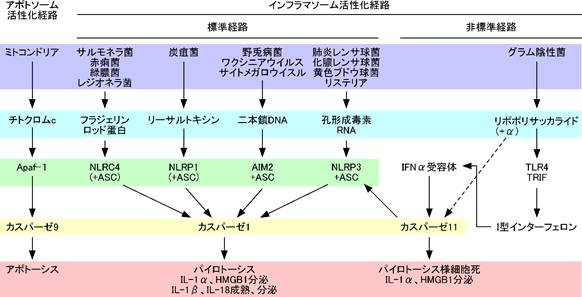
パイロトーシスはインフラマソームと呼ばれるアポトソームに似た複合体の形成によって引き金が引かれる(図1)。インフラマソームの必須構成要素は、上流シグナルを受け取って自ら多量体化することでカスパーゼ1活性化のプラットフォームを形成する蛋白(アポトソームのApaf-1に相当)とカスパーゼ1である。さらに、必要に応じてプラットフォームとカスパーゼ1をつなぐアダプター蛋白であるASCが加わる。プラットフォーム形成分子としてはNLRP1、NLRP3、NLRC4などのNLRファミリーに属する蛋白と、AIM2と呼ばれる蛋白が知られている。これらの分子を活性化する病原体と病原体由来自然免疫活性化物質(pathogen-associated molecular patterns, PAMPs)の一部を図1に記載した。NLRP3はATPや尿酸結晶などのDAMPs、アスベストやシリカなどの環境汚染物質によっても活性化されることが知られている。NLRP3がこれら全てを直接認識するとは考えられず、これらの刺激によって細胞内に生じる何らかの変化をNLRP3が認識しているものと考えられる。インフラマソームに関する詳細な説明は紙面の都合で割愛するので、他の総説[4]などを参照してほしい。
|
図1
アポトーシスとパイロトーシスの誘導経路 病原体を紫、PAMPsを水色、プラットフォーム蛋白を緑、カスパーゼを黄色、細胞の応答を赤でハイライトした。この図で見るとミトコンドリアが病原体、チトクロムcがPAMPsに相当する。アポトーシスの起源が、太古の昔、真核細胞の祖先にミトコンドリアの元となる病原菌が感染したときに、病原菌(ミトコンドリアの祖先)の繁殖を抑えるため、すなわち種の保存の目的で真核細胞の祖先が自殺する機能を獲得したことにあるのではないかと想像させる。 |
パイロトーシスにおけるカスパーゼ1の蛋白分解酵素活性の必要性
パイロトーシスにカスパーゼ1の酵素活性が必要であるとの結論は、多くの論文で、高濃度(50mM以上)のカスパーゼ1阻害剤Ac-YVAD-CMKでパイロトーシスが抑制されたことを根拠にしている。実はそのような濃度のAc-YVAD-CMKはカテプシンB も阻害する[5]。マウスのマクロファージのパイロトーシスについては、カスパーゼ1欠損マウス由来のマクロファージに野生型あるいは酵素活性を持たない変異型のカスパーゼ1を導入する実験で、酵素活性の必要性が裏付けられている[6]。
一方、ヒトのマクロファージの赤痢菌感染による細胞死は、カスパーゼ1阻害剤で抑制されたとする報告[7]と、パンカスパーゼ阻害剤z-VAD-FMKで抑制されなかったとする報告[8]がある。ヒト抹消血単球やヒト単球様細胞株THP-1に赤痢菌や歯周病菌、淋菌などを感染させた場合も、NLRP3とASC依存性にIL-1βの産生を伴うネクローシス様細胞死が誘導される[9-11]。しかし、この細胞死はカスパーゼ1阻害剤で抑制されず、カテプシンB阻害剤CA-074Meで抑制される。そのため、この細胞死はカスパーゼ1非依存性で、パイロトーシスとは異なる細胞死だとされ、パイロネクローシスと呼ばれている。
我々の実験でも、2種類のヒト単球様細胞株に黄色ブドウ球菌や緑膿菌を感染させると、黄色ブドウ球菌はNLRP3依存性に、緑膿菌はNLRC4依存性にネクローシス様の細胞死を誘導した[12]。これらの細胞死はCA-074Meで阻害されたが、IL-1βの産生を強く抑制しうる濃度(1〜10 mM)のAc-YVAD-CMKでは阻害されなかった。ところが、驚いたことにsiRNAやshRNAを用いてカスパーゼ1の発現をノックダウンするとこれらの細胞死は抑制された。したがって、ヒト単球の細菌感染によるネクローシス様細胞死はカスパーゼ1依存性だが、カスパーゼ1の蛋白分解酵素活性は必要ないと考えられる。我々は、パイロネクローシスはパイロトーシスに相当するヒトの細胞死で、カスパーゼ1の酵素活性に対する依存性の違いはマウスとヒトの種差によるものではないかと考えている。
非標準的経路
いわゆるカスパーゼ1欠損マウスのマクロファージがIL-1β産生やパイロトーシスをほとんど起こさないことは、これらの応答がカスパーゼ1依存性であることの最も確かな証拠と考えられてきた。ところが最近、榧垣ら[13]は、これまで使われてきたカスパーゼ1欠損マウスは事実上カスパーゼ1とカスパーゼ11の2重欠損マウスであることを明らかにし、カスパーゼ1の研究者に衝撃を与えた。
榧垣らは、野生型マウス、カスパーゼ11欠損マウス、カスパーゼ1/11二重欠損マウス(カスパーゼ1欠損マウスと思われていたもの)、およびカスパーゼ1/11二重欠損マウスにカスパーゼ11遺伝子を導入したマウス(カスパーゼ1のみ欠損)から骨髄由来マクロファージを調製し、種々のインフラマソーム活性化刺激や細菌感染によるIL-1β産生能と細胞死を調べた。他のグループの報告[14]も総合して要約すると、これまでインフラマソーム研究者が主に研究してきた標準経路(図1中央)で誘導されるIL-1βの産生とパイロトーシスはカスパーゼ1依存性で、カスパーゼ11は必要ない。しかし、多くのグラム陰性菌がカスパーゼ1とカスパーゼ11の両方に依存性にIL-1βの産生を誘導しうることが判明した。これは、LPSなどの刺激でマクロファージがトル様受容体−TRIF経路を介してI型インターフェロンを産生すると、それがオートクラインにカスパーゼ11の発現を誘導し、さらに何らかの細菌成分がカスパーゼ11の活性化を誘導することでNLRP3インフラマソームの形成が促進されるためらしい(図1右)。このカスパーゼ11依存性のインフラマソーム活性化経路は非標準的経路と呼ばれている。また、カスパーゼ11はカスパーゼ1とは独立にパイロトーシス様の細胞死を誘導する。興味深いことに、非標準経路ではIL-1αやHMGB1の放出もカスパーゼ11にのみ依存し、カスパーゼ1は必要ない。おそらくIL-1αはHMGB1などのDAMPsと同様、単純に細胞死に伴って細胞外へ放出されると生理活性を発揮する物質で、カスパーゼ1によるプロセシングが必要なIL-1βとは異なるパターンを示すのだろう。
パイロトーシスの生理的役割
カスパーゼ1欠損マウスは赤痢菌、レジオネラ、野兎病菌などの感染に感受性が高い。カスパーゼ1欠損マウスではIL-1βやIL-18などの炎症性サイトカインの産生が著しく抑制されているので、これは当然かもしれない。しかし、カスパーゼ1欠損マウスは、IL-1βとIL-18の二重欠損マウスに比較しても、さらに野兎病菌感染に対する感受性が高いと報告されている[15]。したがって、カスパーゼ1の感染防御における役割はIL-1βやIL-18の産生だけでは説明できない。
Miaoら[16]は、NLRC4を活性化するフラジェリンを恒常的に発現する組換サルモネラ菌と野生型サルモネラ菌をマウス脾臓内で競合させた。すると、野生型マウスではフラジェリン恒常発現菌は野生型菌より100〜1000倍も効率よく排除された。IL-1β/IL-18二重欠損マウスは野生型マウスと同様、フラジェリン恒常発現菌を効率よく排除したが、カスパーゼ1欠損マウスやNLRC4欠損マウスではフラジェリン恒常発現菌は野生型菌と同等の効率で増殖した。したがって、フラジェリン恒常発現菌はNLRC4およびカスパーゼ1依存性のメカニズムで効率よく排除されるが、これにIL-1βやIL-18は必要ないと考えられる。また、野生型菌とフラジェリン恒常発現菌を別々のマウスに感染させ、脾臓のマクロファージと好中球の数を比較すると、フラジェリン恒常発現菌を感染させた場合はマクロファージが減少し、好中球が増えていた。さらに、フラジェリン恒常発現菌は主に好中球の中にいたのである。これらの結果から、Miaoらはフラジェリン恒常発現菌に感染したマクロファージはパイロトーシスを起こしてサルモネラ菌の増殖の場となる自らを消去し、死んだマクロファージから放出されたサルモネラ菌はより殺菌力の強い好中球に処理させることで、感染防御に寄与しているのではないかと論じている。
では、なぜマクロファージはアポトーシスではなくパイロトーシスで死ぬ必要があるのだろうか。Miaoらの説によれば、細胞内の細菌が放出されるには細胞膜が速やかに崩壊するパイロトーシスの方が都合が良い。また、細胞膜の崩壊により自然免疫を活性化するDAMPsを効率よく放出させることも、パイロトーシスの重要な役割と考えられる。
パイロトーシス細胞の貪食
アポトーシス細胞は自らの死骸をマクロファージに処理させるために、細胞表面にマクロファージの貪食を促すシグナル、いわゆるeat-me signalを発現する。複数のeat-me signalが報告されているが、中でも最も重要で良く研究されているのがフォスファチジルセリン(PS)である[17]。通常、PSは細胞膜の細胞質側に存在するが、アポトーシス細胞では細胞表面に露出する。また、アポトーシス細胞からATPやUTPが放出され、それらがマクロファージ誘引因子、いわゆるfind-me signalとして働く[18]。
一方、パイロトーシス細胞の貪食効率やそのメカニズムに関してはこれまで検討されていなかった。我々は、THP-1細胞に黄色ブドウ球菌や緑膿菌を感染させてパイロトーシスを誘導し、別にマクロファージに分化させたTHP-1細胞と混合し、マクロファージによるパイロトーシス細胞の貪食効率を調べた。その結果、パイロトーシス細胞はアポトーシス細胞に匹敵する効率で貪食されることが判明した[19]。
マクロファージは複数の分子機構でアポトーシス細胞表面のPSを認識する。その一つ、MFG-E8はPS認識部位とインテグリン結合モチーフを持つ分子で、アポトーシス細胞表面のPSとマクロファージ表面のインテグリンを架橋することで、マクロファージによるアポトーシス細胞の貪食を誘導する。そのため、MFG-E8のインテグリン結合モチーフの変異体(D89E)は、マクロファージによるアポトーシス細胞のPS依存性貪食を阻害する[20]。面白いことに、パイロトーシス細胞のマクロファージによる貪食もD89E変異体により阻害された[19]。したがって、パイロトーシス細胞もPS依存性に貪食されるものと考えられる。
さらに、THP-1細胞にアポトーシスあるいはパイロトーシスを誘導し、培養上清中のマクロファージ誘引活性とATP濃度を比較したところ、両方ともパイロトーシス細胞上清の方がアポトーシス細胞上清より高かった。また、パイロトーシス細胞の上清中のマクロファージ誘引活性はアピレースでATPを分解することによって完全に消失した。したがって、パイロトーシス細胞はアポトーシス細胞より効率良くATPを放出し、マクロファージを誘引すると考えられる。
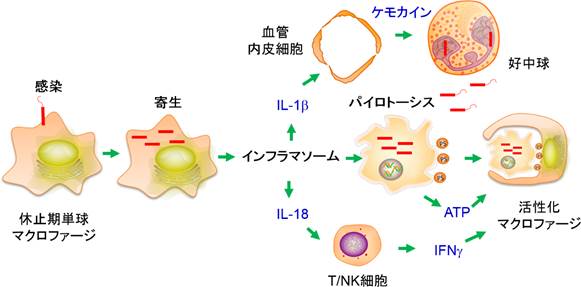
上述のMiaoらの実験で、パイロトーシス細胞から放出された細胞内寄生細菌は好中球によって処理されることが示された。一方、パイロトーシス細胞の中にも細菌は残存すると考えられ、パイロトーシス細胞を貪食したマクロファージが再び細菌に寄生されてしまっては都合が悪い。インフラマソームの活性化によってパイロトーシスとIL-1βやIL-18の産生が同時に起こる理由はおそらくここにある。すなわち、IL-1βは血管内皮細胞などにケモカインの産生を誘導して好中球やマクロファージを引き寄せ、IL-18はT細胞やNK細胞にIFNγの産生を誘導し、IFNγはマクロファージを活性化して殺菌力を高める。これらにより、パイロトーシス細胞から放出された細菌は好中球に処理され、パイロトーシス細胞内に残存した最近は活性化したマクロファージによって死細胞諸共処理されるものと考えられる(図2)。
|
図2
パイロトーシスとIL-1βやIL-18 の分泌が協調して起こることの意義 Miaoらによれば、パイロトーシスを起こしたマクロファージから放出された好中球は好中球に貪食される。また、我々は、パイロトーシス細胞自体はマクロファージによって効率良く貪食されることを見出した。これらに必要な好中球やマクロファージはIL-1βによって血管内皮細胞などから分泌されるケモカインによって呼び寄せられる。また、IL-18はT細胞やNK細胞にインターフェロンγの産生を誘導し、それがマクロファージを活性化することにより、パイロトーシス細胞の中に残っている細菌によって再びマクロファージが寄生されてしまうことを防ぐと考えられる。 |
おわりに
今回は触れられなかったが、パイロトーシスと疾患の関わりも示唆されている。例えばパイロトーシスで放出されるHMGB1がエンドトキシンショックの発症に重要な役割を果たしていることが示唆されている[21]。NLRP3の活性亢進型突然変異はcryopyrin (NLRP3の別名)-associated periodic syndrome (CAPS)と呼ばれる自己炎症性疾患の原因となる。この疾患に対してはアナキンラなどのIL-1阻害薬が有効であることが知られているが、CAPS患者の抹消血単球は正常単球に比べ容易にパイロトーシス(パイロネクローシス)を起こす[22]。このこともCAPSの病態形成に寄与している可能性がある。パイロトーシスは主に細菌感染によるマクロファージや単球の細胞死として研究されているが、神経変性疾患、脳、心臓、腎臓などの虚血性疾患の動物モデルでもIL-1βやIL-18の産生とは別のカスパーゼ1の役割が報告されており、カスパーゼ1依存性細胞死が様々な疾患の病理に関与している可能性がある[23]。今後、パイロトーシスやマクロファージ以外の細胞のカスパーゼ1依存性細胞死の分子機構が明らかになれば、これらの疾患の病理の理解が進み、新しい治療法の開発にもつながることが期待される。
引用文献
1. Bergsbaken, T., et al.: Nature reviews. Microbiology, 7: 99-109. 2009.
2. Cookson, B.T. and Brennan, M.A.: Trends. Microbiol., 9: 113-114. 2001.
3. Brennan, M.A. and Cookson, B.T.: Molecular microbiology, 38: 31-40. 2000.
4. 須田貴司: 実験医学, 30: 566-570. 2012.
5. Schotte, P., et al.: FEBS. Lett., 442: 117-121. 1999.
6. Broz, P., et al.: Cell host & microbe, 8: 471-483. 2010.
7. Hilbi, H., et al.: Infection and immunity, 65: 5165-5170. 1997.
8. Fernandez-Prada, C.M., et al.: Infection and immunity, 65: 1486-1496. 1997.
9. Willingham, S.B., et al.: Cell host & microbe, 2: 147-159. 2007.
10. Huang, M.T., et al.: Journal of immunology, 182: 2395-2404. 2009.
11. Duncan, J.A., et al.: Journal of immunology, 182: 6460-6469. 2009.
12. Motani, K., et al.: J Biol Chem, 286: 33963-33972. 2011.
13. Kayagaki, N., et al.: Nature, 479: 117-121. 2011.
14. Rathinam, V.A., et al.: Cell, 150: 606-619. 2012.
15. Henry, T. and Monack, D.M.: Cellular microbiology, 9: 2543-2551. 2007.
16. Miao, E.A., et al.: Nature immunology, 11: 1136-1142. 2010.
17. Nagata, S., et al.: Cell., 140: 619-630. 2010.
18. Elliott, M.R., et al.: Nature, 461: 282-286. 2009.
19. Wang, Q., et al.: International immunology. 2013.
20. Hanayama, R., et al.: Nature., 417: 182-187. 2002.
21. Lamkanfi, M., et al.: Journal of immunology, 185: 4385-4392. 2010.
22. Saito, M., et al.: Blood, 111: 2132-2141. 2008.
23. Denes, A., et al.: Cell death & disease, 3: e338. 2012.
サイドメモ
*1 命名者のCooksonは、pyroptosisの2番目のpは発音しないとレヴュー(1)に書いているので、それにしたがって本稿ではパイロトーシスと標記した。
*2 Danger-associated molecular patternsの略とされることもある。細胞死に伴って放出され、自然免疫応答ないしは炎症応答を誘導する細胞内物質のこと。自然免疫系を活性化する病原体由来物質をpathogen-associated molecular patterns (PAMPs)と呼ぶことになぞらえた名称。