�C���t���}�\�[���ƍזE��
������w�@2012, 30:566-570
�{�c�M�i�E�����w�@����i�W���䌤�����@�Ɖu���ǐ��䌤������
�T�}���[
�}�N���t�@�[�W�͍זE���ւ̕a���̂̐N�������m����ƁA�C���t���}�\�[���ƌĂ��`�������̂��`�����ăJ�X�p�[�[1������������B���̌��ʁAIL-1����IL-18�Ȃǂ̃T�C�g�J�C�������傳�ꉊ�ǁE�Ɖu������U������Ƌ��ɁA�}�N���t�@�[�W�̓p�C���g�[�V�X�ƌĂ��J�X�p�[�[1�ˑ����̍זE�����N�����B�ǂ������Ńq�g�P���זE�̓p�C���l�N���[�V�X�ƌĂ��J�X�p�[�[1��ˑ����̍זE�����N�����ƕ���Ă��邪�A��X�͂��̍זE�����J�X�p�[�[1�ˑ����ł��邱�Ƃ��������B�p�C���g�[�V�X��p�C���l�N���[�V�X�͌`�ԓI�ɂ̓l�N���[�V�X�̓����������זE���ŁA�A�|�g�[�V�X�Ƃ͈قȂ鉊�ǗU�����̃v���O�����זE���ƍl������B
����
BIR, baculovirus inhibitor of apoptosis protein repeats
CARD, caspase-recruitment domain
DAMPs, danger-associated molecular patterns
HIN-200, hemopoietic interferon-inducible nuclear proteins with a 200-amino acid motif
LRR, leucine-rich repeats
MDP, muramyl dipeptide
NLR, nucleotide-binding domain and leucine-rich repeat-containing
NOD, nucleotide-binding and oligomerization domain
PYD, pyrin domain
PAMPs, pathogen-associated molecular patterns
WD40R, WD40 repeats
�͂��߂�
IL-1����IL-18�̓}�N���t�@�[�W�Ȃǂ��番�傳��A���ǔ�����Ɖu������U������T�C�g�J�C���ł���B�����̃T�C�g�J�C���́A�J�X�p�[�[1�ɂ��v���h���C���i�O��̗̈�j���ؒf�A��������邱�ƂŊ����^�ɂȂ�A���傳���B�J�X�p�[�[1���g���i���̃J�X�p�[�[���l�j�A�~�m���[�Ƀv���h���C�������`���[�Q���Ƃ��ĎY������A���ȏ������邢�͑��̃J�X�p�[�[�ɂ���ăv���h���C����������A����ɍy�f�̈����T�u���j�b�g�A���T�u���j�b�g�ɐؒf����A�����2�̃T�u���j�b�g�������̂��`�����邱�ƂŐ��n�^�ɂȂ�B����܂ŃJ�X�p�[�[1���ǂ̂悤�ɂ��Ċ����������̂��s���ł��������A�ߔN�A�J�X�p�[�[9�̊�������S�������̂ł���A�|�g�\�[���i�}1�j�ɑ�������J�X�p�[�[1�������U�������̂̍\���`�������炩�ɂȂ��Ă����B�J�X�p�[�[1�����ǁiinflammation�j�̗U���ɓ������Ƃ���A���̕����̂̓C���t���}�\�[��(inflammasome)�ƌĂ�Ă���B
����A�ۂ�E�C���X�Ɋ��ꂽ�}�N���t�@�[�W�͂����l�N���[�V�X���N�����Ď��ʁB�\���I�זE���ł���A�|�g�[�V�X�ɑ��A��ʂɃl�N���[�V�X�͎I�זE���ƈʒu�t�����Ă���A�ۊ����ɂ��}�N���t�@�[�W�̍זE�����A�T�^�I�ȎI�זE���ƍl�����Ă����B�������A�ߔN�A���̂悤�ȍזE�����\���I�ȍזE���ł��邱�Ƃ��������A�p�C���g�[�V�X��p�C���l�N���[�V�X�ƌĂ�Ă���B
�P�D�C���t���}�\�[��
Apaf-1�ƍ\�����ގ������J�X�p�[�[1�������U�����q�Ƃ��čŏ��ɕ��ꂽ�̂�NLRC4�ł���1)�BNLRC4��Apaf-1���l�A�A�~�m���[��caspase-recruitment domain (CARD)�A���q������nucleotide-binding and oligomerization domain (NOD)�����i�}1�j�B�܂��A�J���{�L�V�����[�ɂ�WD40 repeats (WD40R)�̑����leucine-rich repeats (LRR)�����݂���BNLRC4�̔����ƑO�サ��NOD��LRR�����`����������������Anucleotide-binding domain and leucine-rich repeat-containing (NLR*1)�t�@�~���[�ƌĂ�Ă���B������NLR�`���́A�A�~�m���[��CARD�Apyrin domain (PYD)�A�܂���baculovirus inhibitor of apoptosis protein repeats (BIR)�����BPYD��CARD���l�A�f�X�h���C���X�[�p�[�t�@�~���[�ɑ�����z���t�B���b�N���ݍ�p�h���C���ŁA��{�I��CARD��CARD�ƁAPYD��PYD�ƌ�������B�q�g�ɂ�22��ނ�NLR�`�������݂��邪�A���̓��ANLRC4�ANLRP1�ANLRP3���J�X�p�[�[1�̊������ɓ����i�}1�j�B
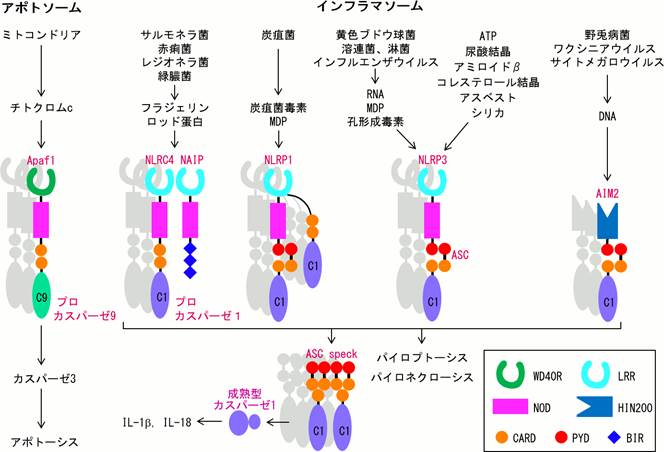
�}1�D�i���j�A�|�g�[�V�X�̉ߒ��ł́A�~�g�R���h���A����זE���֕��o���ꂽ�`�g�N����c��Apaf-1�Ɍ������邱�Ƃ����������Ƀ`�g�N����c�AATP�AApaf-1�A�J�X�p�[�[9����Ȃ镡���̂������7�ʑ̉��������啡���́A�A�|�g�\�[�����`�������B�i�E�j�l�X��PAMPs��DAMPs�A���������C���t���}�\�[���̌`����U������BASC��PYD��CARD����Ȃ�ANLR�`����AIM2�ƃJ�X�p�[�[1���Ȃ��A�_�v�^�[�`���Ƃ��ċ@�\����B�܂��A�X�y�b�N�ƌĂ��ÏW����`�����āA�J�X�p�[�[1�̊�������U������B
�@NLRC4��CARD�ɂ̓J�X�p�[�[1�ƃA�_�v�^�[�`��ASC�����ڌ���������BNLRC4�͒��ڃJ�X�p�[�[1�������������邪�AASC�����}�E�X�ł�NLRC4�ˑ�����IL-1���Y�����}������Ă��邱�Ƃ���AASC�͉��炩�̌`��NLRC4�̋@�\�Ɋ�^���Ă���ƍl������2)�B�q�gNLRP1�̓A�~�m���[��PYD�A�J���{�L�V�����[����CARD�������A�}�E�X�̃z�����O(NLRP1a, NLRP1b)�ɂ�PYD�������BNLRP1��CARD�ɃJ�X�p�[�[1�����ڌ�������BNLRP1��NLRP3��PYD�ɂ�ASC����ăJ�X�p�[�[1����������B
������NLR�`���͗l�X�ȕa���̊֘A����(pathogen-associated molecular patterns, PAMPs)�ɉ�������(�}1)�BNLRC4�́ABIR������NLR�`���ł���NAIP�Ƌ��ɍەږт̃t���W�F������III�^���呕�u�̃��b�h�`���ɉ�������i�}1�j�B�}�E�X�ɂ�7��ނ�NAIP������A����炪NLRC4�̃��K���h���ِ������߂Ă���3,4)�B�q�g��NLRP1�͍ۃy�v�`�h�O���J���̕����\���ł��郀���~���W�y�v�`�h�imuramyl dipeptide, MDP�j�ɉ�������Ƃ���Ă���5)���A�}�E�XNLRP1b�͒Y�s�ۓőf�ɉ�������BNLRP3�͕a���̂�RNA��MDP�Ȃǂ�PAMPs�A�ۂ̍E�`���őf�AATP�A�A�_�����A���A�~���C�h�A�R���X�e���[�������Ȃǂ̓��ݐ��̊댯�֘A����(danger-associated molecular patterns, DAMPs�j�A�A�X�x�X�g�A�V���J�Ȃǂ̊����������ȂǗl�X�Ȏh���ɉ�����6-10)�A�ɕ��A�A���c�n�C�}�[�a�A�����d���A�����A�]�x�ȂǗl�X�Ȏ����Ɋ֗^����ƍl�����Ă���B����NLRP3������قǑ��l�ȕ����ɉ���������̂��͕s���ł���BTHP-1�q�g�P���n�זE���ł́ANLRC5���E�`���őf�ȊO�̎h���ɂ��NLRP3�C���t���}�\�[���̊������ɕK�v�ł���11)�B�������ANLRC5�����}�E�X��NLRP3�ˑ���IL-1���Y���Ɉُ�͔F�߂�Ȃ�12)�B���������āANLRC5��NLRP3�̃��K���h���ِ������߂Ă���Ƃ͍l���ɂ����B
NLR�t�@�~���[�ȊO�ł́AAIM2���B��C���t���}�\�[�����`������13,14)�BAIM2��PYD��hemopoietic interferon-inducible nuclear proteins with a 200-amino acid motif (HIN-200)�̈悩��Ȃ�AASC����ăJ�X�p�[�[1�ƌ�������BDNA�E�C���X���e�a�ۊ����ɂ��}�N���t�@�[�W��IL-1���Y���ɏd�v�Ȗ������ʂ����Ă���15,16)�i�}1�j�B
2�D�p�C���g�[�V�X�ƃp�C���l�N���[�V�X
�l�X�ȕa���̂��}�N���t�@�[�W�ɃJ�X�p�[�[1�ˑ����̃l�N���[�V�X�l�זE����U������B���̂悤�ȍזE���̓p�C���W�F���ł���IL-1���̎Y�����זE���ł��邱�Ƃ���p�C���g�[�V�X�ƌĂ�Ă���17)�B���ہA�J�X�p�[�[1�����}�E�X�R���̃}�N���t�@�[�W�͗l�X�ȍזE���ۂ�E�C���X�����ɂ��זE�����}������Ă���B�T�����l���ہA�Δ^�ۂɑ��Ă�NLRC4�����}�N���t�@�[�W 2,18)�A��e�a�ۂ�N�V�j�A�E�C���X�ɑ��Ă�AIM2�����܂��̓m�b�N�_�E���}�N���t�@�[�W�����l�ɒ�R��������13,16)�B
���F�u�h�E���ہA�����a�ہA�ҋہA�A�f�m�E�C���X�Ȃǂ̊����ɂ��q�g�P����IL-1���̎Y�����l�N���[�V�X�l�̍זE�����N�����B���̍זE����NLRP3��ASC��K�v�Ƃ��邪�A�J�X�p�[�[1�̑j�Q�܂ł͗}�����ꂸ�A�J�e�v�V��B�j�Q�܂Ƃ��Ēm����CA-074Me�őj�Q����邱�Ƃ���A�p�C���g�[�V�X�Ƃ͈قȂ�זE���ł���ƍl�����A�p�C���l�N���[�V�X�ƌĂ�Ă���19-22)�B
��X�̎����ł��A���F�u�h�E���ۊ����ɂ��q�g�P���n�זE��NLRP3�ˑ����̃l�N���[�V�X�l�זE���i�}2�j�́ACA-074Me�őj�Q����邪�AIL-1���̕����}������Z�x��10�{�̔Z�x�ŃJ�X�p�[�[1�j�Q�܂������Ă��قƂ�Ǘ}�����ꂸ�A�p�C���l�N���[�V�X�̐������������B�Ƃ��낪���������ƂɁA���̍זE���̓J�X�p�[�[1�̔������m�b�N�_�E������Ɨ}�����ꂽ23)�B����ɁA�Δ^�ۊ����ɂ��NLRC4�ˑ����זE�����J�X�p�[�[1�̃m�b�N�_�E���ŗ}�����ꂽ���A�J�X�p�[�[1�̑j�Q�܂ł͗}������Ȃ������B���̎������ʂ����킹�A���݉�X�́A�@�ۊ����ɂ��NLRP3������������Ă��ANLRC4������������Ă��A�q�g�P���̓p�C���l�N���[�V�X���N�����A�A���̃p�C���l�N���[�V�X�ɂ̓J�X�p�[�[1�̃v���e�A�[�[�����͕K�v�Ȃ����A�J�X�p�[�[1�`�����d�v�Ȗ������ʂ����Ă���A�ƍl���Ă���B
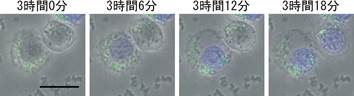
�}2�DTHP-1�q�g�P���n�זE����FITC(��)�W���������F�u�h�E���ۂ����������A4,6-diamidino-2-phenylindole (DAPI�A��)���݉���3���Ԍォ��6���Ԋu�Ń^�C�����v�X�B�e���s�����B�l�N���[�V�X�ōזE�����j�]�����זE�͊j��DAPI�Ő��F����A�זE���c������B���̎��_�Ŋj�̎��k��N���}�`���̋ÏW�͊ώ@����Ȃ��B
�ŋ�Broz��24)�́A�}�E�X�̃}�N���t�@�[�W�ɃT�����l���ۂȂǂ����������ėU�������p�C���g�[�V�X�̎����n�ŁA���q���̃J�X�p�[�[�ؒf�T�C�g��S�ĕψق����A���n�^�ɓ]���ł��Ȃ��J�X�p�[�[1�ψّ̂́AIL-1���̃v���Z�V���O�͂ł��Ȃ����A�p�C���g�[�V�X�͋N�����邱�Ƃ��������B�������A�J�X�p�[�[1�̊������S�̕ψّ̂ł̓p�C���g�[�V�X���U���ł��Ȃ����Ƃ���A�p�C���g�[�V�X�ɂ̓J�X�p�[�[1�̃v���e�A�[�[�������K�v�ł���ƌ��_���Ă���B�������A�p�C���g�[�V�X��CA-074Me�ŗ}�������Ƃ���������25)�A��X�́A�p�C���l�N���[�V�X�ƃp�C���g�[�V�X�̓q�g�ƃ}�E�X�̑����̍זE���ł���A�J�X�p�[�[�����ˑ����̈Ⴂ�̓q�g�ƃ}�E�X�̎퍷�ł͂Ȃ����ƍl���Ă���B
��q�̂悤�ɁANLRC4�ˑ�����IL-1���Y���ɂ�ASC���d�v�Ȗ������ʂ������ABroz��́ANLRC4�ˑ����p�C���g�[�V�X�ɂ�ASC���K�v�Ȃ����Ƃ��������BASC�͊����������ƃX�y�b�N�ƌĂ�鋐��ȋÏW����`������(�}1,3)�BBroz��́ANLRC4�͊���������ƃJ�X�p�[�[1�ƕ����̂��`�����A����ɂ���ăJ�X�p�[�[1�͂��ꎩ�g�̃v���Z�V���O���N���Ȃ��Ă�������x�v���e�A�[�[�������l�����ăp�C���g�[�V�X���N�������Ƃ��ł��邪�AIL-1���̃v���Z�V���O�������悭�U������ɂ́A�����ASC�X�y�b�N���`������A�����ŃJ�X�p�[�[1���g���v���Z�V���O�ɂ���Đ��n����K�v������Ƃ������f������Ă���i�}1�j�B
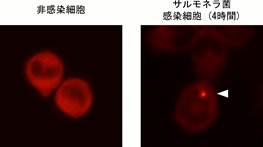
�}3�D��(��)�A�܂��̓T�����l���ہiSalmonella typhimurium�j������������NOMO-1�q�g�P���n�זE(�E)���RASC�R�̂ŖƉu���F�����B�����זE�ɂ�ASC�̋���ȋÏW��(�X�y�b�N�A�)���A�����̏ꍇ��̍זE�Ɉ�`�������B
3. �p�C���g�[�V�X�A�p�C���l�N���[�V�X�̐����I����
�ۊ����ɂ��}�N���t�@�[�W�̃l�N���[�V�X���I�ȍזE���ƍl�����Ă������́A�ۂ��}�N���t�@�[�W�ɂ��E�ۂ�Ƃ�邽�߂Ƀ}�N���t�@�[�W���E���Ă���ƍl�����Ă����B�������A���ۂɂ́A�ۂɊ��ꂽ�}�N���t�@�[�W���\���I�Ɏ��ʂ̂ł���A���̂��Ƃ��ۂ̔ɐB�𐧌����邽�߂̐����I�ȉ����ł���\��������BMia��26)�́A��X�̈�`�q�����}�E�X�Ƀt���W�F�������P��I�ɔ�������T�����l���ۂ�ڎ킵�A�ۂ̔r���Ɋ�^����h���`�q�����������B���̌��ʁANLRC4�ƃJ�X�p�[�[1�͕K�v�����AASC�AIL-1��e�́AIL-1���AIL-18�͂قƂ�NJ�^���Ȃ����Ƃ����������B�����̌��ʂ́A�C���t���}�\�[�����`������邱�Ƃɂ��IL-1����IL-18���Y������邱�Ƃł͂Ȃ��A�p�C���g�[�V�X���N���邱�Ƃ��ۂ̔r���ɏd�v�ł���ƍl����Ƃ悭�����ł���B����ɁA�ނ�̓T�����l���ۂ��}�E�X�ɐڎ킵��48���Ԍ�ɐl�H�I�Ƀt���W�F�����̔�����U������ƁA�ۂ��ÐH�����}�N���t�@�[�W�����ɁA����ɋۂ��ÐH�����D�����������邱�Ƃ��������B�����̌��ʂ���A�}�N���t�@�[�W���p�C���g�[�V�X���N�����ƁA�T�����l���ۂ͍זE�O�ɕ��o����A�}�N���t�@�[�W���E�ۗ͂������D�������ÐH����邱�ƂŌ����悭�r�������̂ł͂Ȃ����Əq�ׂĂ���B�܂��A�l�N���[�V�X���N�������זE�͍זE���e�������͂ɕ��o���邪�A�����̒��ɂ͗l�X��DAMPs���܂܂�Ă���B���̂悤�Ȏ��זE�R��DAMPs�Ƃ��Ă悭�m����HMGB1*2�́A�p�C���l�N���[�V�X���N�������זE��������o�����27)�B�]���āA�p�C���g�[�V�X��p�C���l�N���[�V�X��DAMPs�̕��o�𑣂����ƂŁA���ǁE�Ɖu�����𑣐i����\��������B
������
�C���t���}�\�[���̍\�����q�����炩�ɂȂ��Ă������ƂŁA�J�X�p�[�[1�̊������@�\�����炩�ɂȂ��Ă����B�������A�C���t���}�\�[���̐����w�I���Ԃɂ͕s���ȓ_�������B�����ł͏ڂ����q�ׂȂ��������A�C���t���}�\�[���͗l�X�Ȏ����Ɋ֗^���Ă���AIL-1��e�̃A���^�S�j�X�g���܂������̎����̎��ÂɗL���ł��邱�Ƃ����������B�C���t���}�\�[���ɂ�����J�X�p�[�[1�������@�\�̏ڍׂ����炩�ɂȂ�A�C���t���}�\�[���֘A�����ɑ���ᕪ�q���Ö�̊J�����\�ɂȂ�Ɗ��҂����B�p�C���g�[�V�X�ƃp�C���l�N���[�V�X�Ɋւ��ẮA�J�X�p�[�[1����זE���Ɏ���V�O�i���`�B�o�H���قƂ�Ǖ������Ă��炸�A���̓_������̌����̈�̏œ_�ɂȂ�ł��낤�B�܂��A�����̍זE���̐����I�E�a���I�Ӌ`�A���זE������o����鐶���������q�̓���₻�̖����̉𖾂�����̉ۑ�ł���B
�p����
*1 NLR, NOD-like receptor�̗��Ƃ���_�����������ANLR�`���Ɗe�X�̊������U�������̒��ړI�Ȍ������ؖ����ꂽ��͏��Ȃ��A���Z�v�^�[�Ƃ����ď̂��K�ł��邩�^��ł���B
*2 HMGB1, HMGB1�͐��זE���ł͊j�`���Ƃ��ċ@�\���邪�A�זE���l�N���[�V�X���N�����ƍזE������o����A���ǗU����p�������B
����
1) Poyet, J. L. et al.: J Biol Chem, 276:28309-28313, 2001
2) Mariathasan, S. et al.: Nature, 430:213-218, 2004
3) Zhao, Y. et al.: Nature, 477:596-600, 2011
4) Kofoed, E. M. & Vance, R. E.: Nature, 477:592-595, 2011
5) Faustin, B. et al.: Mol Cell, 25:713-724, 2007
6) Martinon, F. et al.: Nature, 440:237-241, 2006
7) Halle, A. et al.: Nat Immunol, 9:857-865, 2008
8) Mariathasan, S. et al.: Nature, 440:228-232, 2006
9) Duewell, P. et al.: Nature, 464:1357-1361, 2010
10) Dostert, C. et al.: Science, 320:674-677, 2008
11) Davis, B. K. et al.: J Immunol, 186:1333-1337, 2011
12) Kumar, H. et al.: J Immunol, 186:994-1000, 2011
13) Hornung, V. et al.: Nature, 458:514-518, 2009
14) Fernandes-Alnemri, T. et al.: Nature, 458:509-513, 2009
15) Rathinam, V. A. et al.: Nat Immunol, 11:395-402, 2010
16) Fernandes-Alnemri, T. et al.: Nat Immunol, 11:385-393, 2010
17) Cookson, B. T. & Brennan, M. A.: Trends Microbiol, 9:113-114, 2001
18) Sutterwala, F. S. et al.: J Exp Med, 204:3235-3245, 2007
19) Craven, R. R. et al.: PLoS One, 4:e7446, 2009
20) Huang, M. T.-H. et al.: J Immunol, 182:2395-2404, 2009
21) Duncan, J. A. et al.: J Immunol, 182:6460-6469, 2009
22) Barlan, A. U. et al.: J Virol, 85:146-155, 2011
23) Motani, K. et al.: J Biol Chem, 286:33963-33972, 2011
24) Broz, P. et al.: Cell Host Microbe, 8:471-483, 2010
25) Averette, K. M. et al.: PLoS One, 4:e7913, 2009
26) Miao, E. A. et al.: Nat Immunol, 11:1136-1142, 2010
27) Willingham, S. B. et al.: Cell Host Microbe, 2:147-159, 2007