表1. 自己炎症性疾患と変異遺伝子(文献2)および51)より改変)
|
Syndromes |
変異遺伝子 |
|
Hereditary periodic fever
syndromes |
|
|
Familial
Mediterranean fever (FMF) |
MEFV |
|
TNF
receptor–associated periodic syndrome (TRAPS) |
TNFRSF1A |
|
Hyperimmunoglobulinemia
D with periodic fever syndrome (HIDS) |
MVK |
|
Familial
cold autoinflammatory syndrome (FCAS) |
NALP3, NLRP12 |
|
Muckle-Wells
syndrome (MWS) |
NALP3 |
|
Chronic
infantile neurologic cutaneous and articular (CINCA) syndrome |
NALP3 |
|
Idiopathic febrile syndromes |
|
|
Periodic
fever with aphthous stomatitis, pharyngitits, and cervical adenopathy (PFAPA) |
— |
|
Systemic-onset
juvenile idiopathic arthritis (SOJIA) |
IL-6, MIF |
|
Adult-onset
Still’s disease |
— |
|
Granulomatous disorders |
|
|
Crohn’s disease |
NOD2 |
|
Blau
syndrome |
NOD2 |
|
Early
onset sarcoidosis |
NOD2 |
|
Pyogenic disorders |
|
|
Syndrome
of pyogenic arthritis with pyoderma gangrenosum and acne (PAPA) |
PSTPIP1 |
|
Chronic
recurrent multifocal osteomyelits (CRMO) |
LPIN2 |
|
Synovitis,
acne, pustulosis, hyerostosis, and osteitis syndrome (SAPHO) |
— |
|
Hemophagocytic disorders |
|
|
Primary
hemophagocytic lymphohistiocytosis |
PRF1, RAB27A |
|
Macrophage
activation syndrome (MAS) |
|
|
Complement disorders |
|
|
Hereditary
angioedema |
C1NH |
|
Vasculitic syndromes |
|
|
Behçet’s disease |
HLAB51 |
|
Metabolic disorders |
|
|
Gout |
— |
|
Familial
chondrocalcinosis (pseudogout) |
ANKH |
|
Storage diseases |
|
|
Gaucher's
disease |
GBA |
|
Hermansky–Pudlak syndrome |
HPS1, HPS3, HPS4, HPS5, HPS6, AP3B1,
DTNBP1, BLOC1S3 |
|
Fibrosing disorders |
|
|
Idiopathic
pulmonary fibrosis |
SFTPA1, SFTPA2, TERT, TERC |
1.
NLRファミリーのドメイン構造と機能
NLRは上述のNODとLRRに加え、アミノ末端に存在する蛋白間相互作用領域からなる(図1A)。このようなドメイン構造はアポトーシスのシグナル伝達で重要な役割を果たす細胞質蛋白質Apaf-1 (Apoptotic protease activating facor-1)との類似性が高く、ドメイン構造と機能の関係もApaf-1のそれと似ていると想像されている。
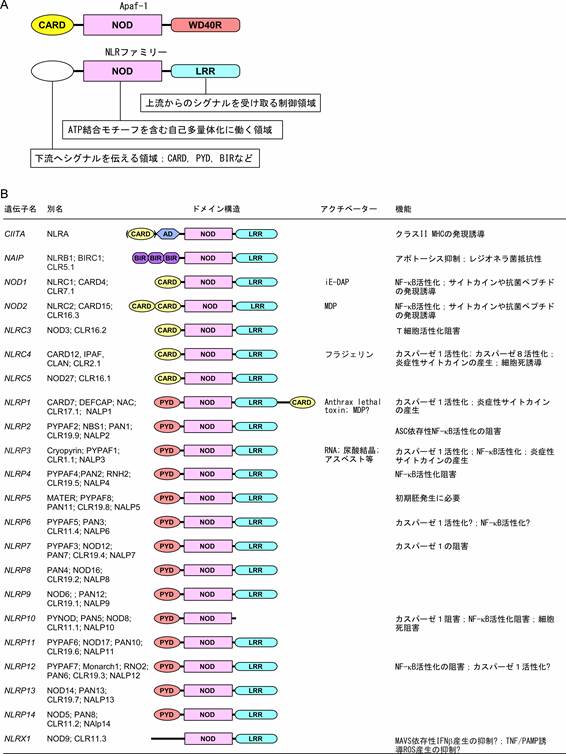
図1. NLRの基本構造と機能
A. NLR蛋白はアミノ末端の蛋白間相互作用ドメイン、中央のNOD、カルボキシル末端のLRRからなる。Apaf-1との構造上の類似性から、アミノ末端のドメインは下流にシグナルを伝達するための領域、NODはATPを結合し、自己多量体化に働く領域、LRRはリガンドや上流のシグナル伝達物質を認識する領域と考えられる。B. ゲノム解析などから、ヒトで20腫を越えるNLR蛋白が発見されている。多くのNLR蛋白がアポトーシスと炎症の誘導または制御に働いている。
中央のNODはApaf-1にも存在する構造で、ATPの結合と多量体化に働く部分である。幾つかのNLR蛋白では実際にNODにATPが結合し、その核酸結合モチーフがNLR蛋白の機能に重要であることが示されている。
Apaf-1のカルボキシル端の構造はLRRではなくWD40リピートだが、WD40リピートとLRRはユニットの構造は全く異なるものの、繰り返すことで全体として馬蹄形の構造を取るという共通点がある。また、NLRのLRRとApaf-1のWD40リピートは類似の機能を果たすと考えられている。すなわち、Apaf-1のWD40リピートが普段Apaf-1の多量体化を抑制し、チトクロムcの結合によりその抑制を解除する制御領域として働いているが、NLRのLRRも何らかのリガンドを認識してNLR蛋白の機能を調節する制御領域と考えられている。NLRP3やNLRC4では、実際にLRRを欠失させると恒常活性型になることが示されている。また、TLRのLRRはPAMPを直接認識することが構造解析からも明らかになっており、NLRのLRRも同等の機能を持つと想像されている。しかし、NLRのLRRがPAMPと直接結合するという証拠は現時点では乏しいし、全てのNLRがパターン認識受容体として働くと言うことではない可能性も大きい。
NLRのアミノ末端には、主に3種類のドメイン構造のいずれかが存在する。そのうちの2種類はカスパーゼ結合領域(caspase recruitment domain, CARD)とパイリン領域(Pyrin-domain, PYD)で、これらは共にデスドメインスーパーファミリーに属するホモフィリック相互作用(相似のドメイン同士が親和性を持つ)領域である。ちなみにApaf-1のアミノ末端にもCARDが存在し、カスパーゼ9のCARDが結合する。もう一種はバキュロウイルスのアポトーシス阻害蛋白に見られるBIR (baculovirus inhibitor of apoptosis protein repeat)と呼ばれる構造で、BIRを持つNLRメンバーであるNAIPはアポトーシス抑制作用を持つことが知られている。NAIPはヒトでは1種類しか存在しないが、マウスでは7種類存在する。この他、アミノ末端に転写活性化領域を持つものや既知のドメイン構造が同定されていないものもある。
NLRファミリーの多くのメンバーは同時期に多くの研究者によって発見されたため、非常に沢山の名前が付けられてしまった(図1B)。そのため、HUGO Gene
Nomenclature CommitteeはNLRを語幹とした統一名称を提唱している。これらの名称の4文字目はこの蛋白がアミノ末端に持つドメインのタイプを示している。すなわち、アミノ末端に転写活性化領域(activation domain)をもつものはNLRA、BIRを持つ仲間はNLRB、CARDを持つ仲間はNLRC、PYDを持つものはNLRP、未知の領域を持つものはNLRXと命名される。ただし、この命名法には当初から強い反発もあり、CIITA、NAIP、NOD1、NOD2はそれらの名前が既に定着しているとして、そのままの名前で呼ばれている。我々が発見したPYNODはNLRP10と命名された。しかし、PYNODにはLRRが存在せず、NLRP10という名前は適切ではない。
2.
自然免疫系におけるNLRの役割
NLRファミリーは免疫(獲得免疫を含む)、炎症、細胞死、がんなどにおける役割が報告されているが、紙面の都合でここでは自然免疫系における役割に絞って解説する。また、機能がほとんど分かっていないものも多く残されている。
2-1)NOD1, NOD2
NLR蛋白の仲間がパターン認識受容体として働いていることを初めて示したのはInoharaら3)とGirardinら 4) である。彼らはNOD2が細菌細胞壁を構成するペプチドグリカンに応答し、免疫/炎症で重要な働きをする転写因子NF-κBの活性化を誘導することを明らかにした。NOD1もペプチドグリカンに応答するが、NOD1とNOD2の認識する構造は異なる5)。グラム陰性菌と一部のグラム陽性菌のペプチドグリカンはメソ-ジアミノピメリン酸とD-アラニンの間に架橋を形成するが、多くのグラム陽性菌のペプチドグリカンはL-リジンとD-アラニンの間に架橋を形成する(図2A)。NOD1は前者のペプチドグリカンに特有のγ-D-グルタミル-メソ-ジアミノピメリン酸(iE-DAP)に応答する5)のに対し、NOD2は両者のペプチドグリカンに共通に存在するムラミルジペプチド(MDP)に応答する(図2B)。そのため、NOD1が応答しうる細菌のスペクトラムはNOD2に比べ限定されると考えられる。NOD1やNOD2はRIPK2(receptor-interacting
serine-threonine kinase 2)を介してNF-κB
の活性化を誘導することで様々なサイトカインや抗菌ペプチドの発現を誘導し、自然免疫の活性化に働く。
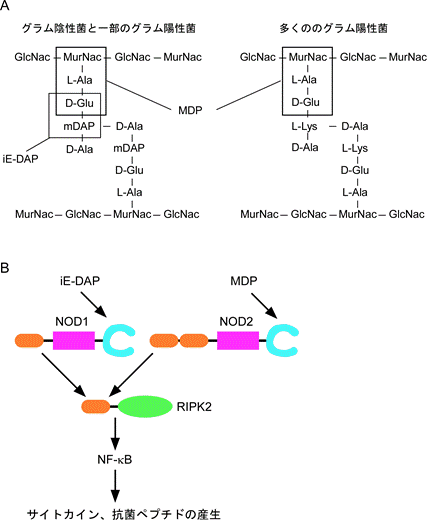
図2. NOD1、NOD2の活性化因子とシグナル伝達
A. NOD1はグラム陰性菌と一部のグラム陽性菌のペプチドグリカンに存在するiE-DAPを認識する。一方、NOD2はほとんどの細菌ペプチドグリカンに存在するMDPを認識する。B. NOD1、NOD2はRIPK2を介してNF-κBの活性化を誘導し、サイトカインや抗菌ペプチドの産生を誘導する。
2-2)
NLRC4、NLRP3、NLRP1
NLRC4やNLRP3はカスパーゼ1の活性化を誘導し、この蛋白分解酵素による前駆体領域の切断によって活性化されるIL-1βやIL-18などの炎症性サイトカインの成熟・分泌に重要な役割を果たす。
NLRC4欠損マウス由来のマクロファージは、リポポリサッカライド前処理後にATPで刺激することで誘導されるカスパーゼ1の活性化とIL-1βやIL-18の産生は正常に起きるが、サルモネラ菌感染によるこれらの応答がほとんど認められない6)。このマウスでは、他にも赤痢菌、緑膿菌、レジオネラ菌などの感染によるカスパーゼ1依存性の炎症性サイトカイン産生が著しく抑制されている。これは、NLRC4が細菌の鞭毛蛋白であるフラジェリンに特異的に応答して、カスパーゼ1を活性化するためである (図3)。実際、フラジェリンを欠損したサルモネラ菌はマクロファージのIL-1β産生をほとんど誘導しないことが示されている7) 8)。しかし、フラジェリン欠損赤痢菌はIL-1βの産生を誘導しうることから、フラジェリン以外にもNLRC4を活性化するものがあると考えられる。
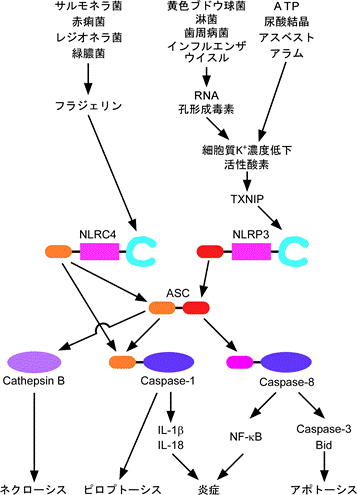
図3. NLRC4、NLRP3の活性化因子とシグナル伝達
NLRC4は細菌の鞭毛蛋白フラジェリンにより活性化される。一方、NLRP3は細菌のRNAや孔形成毒素、ウイルスRNAの他、ATP、尿酸結晶などの内因性炎症誘導物質、アスベスト、シリカ、アラムなどの炎症誘導性無機物により活性化される。これらの物質は細胞内K+濃度の低下や活性酸素の産生を誘導する。ごく最近、活性酸素がチオレドキシンからTXNIPを遊離させ、それがNLRP3の活性化を誘導することが報告された。NLRP3はASCを介して、またNLRC4は直接カスパーゼ1を活性化してIL-1βの産生やパイロトーシスを誘導する。また、ASCの下流ではカスパーゼ8依存性のアポトーシスやNF-κBの活性化、カテプシンB依存性のネクローシスも誘導される。
一方、溶連菌、黄色ブドウ球菌やポルフィロモナス・ジンジバリス、インフルエンザウイルスなどはNLRP3依存性に、IL-1βの成熟・分泌を誘導する(図3)。NLRP3は細菌やウイルス由来のRNAに応答してカスパーゼ1の活性化を誘導する。このため、NLRP3欠損マウス由来のマクロファージは細菌RNAやウイルスRNAによるIL-1β/IL-18産生が著しく抑制されている9) 10)。また、溶連菌や黄色ブドウ球菌感染によるNLRP3の活性化には菌の産生する孔形成毒素が関与している11) 12)。
興味深いことに、NLRP3は尿酸結晶やATPの様な内因性物質、アスベストやシリカのような無機物にも応答する13) 14) 15)。これらの物質はパターン認識受容体を活性化するが、病原微生物由来ではないことから、danger-associated molecular pattern (DAMP)と呼ばれている。尿酸結晶は痛風、アスベストは中皮腫、シリカは珪肺症の原因物質であり、これらの疾患にNLRP3が関わっている可能性がある。
NLRP3がなぜこのように由来も構造も全く異なる様々な物質に応答できるかは不明であったが、NLRP3を活性化しうる物質は細胞質K+濃度の低下や活性酸素の産生を誘導し、これらのことがカスパーゼ1の活性化に必要であることが示されていた。ごく最近、これらの物質は活性酸素の産生を誘導することで、チオレドキシンからTXNIP (thioredoxin-interacting protein)を遊離させ、そのTXNIPがNLRP3のLRRに結合することでNLRP3を活性化することが報告された16)。この場合、NLRP3はパターン認識受容体ではなく、パターン認識受容体の下流で働く細胞質シグナル伝達因子と言うべきであろう。
NLRP3は活性化するとASCと呼ばれるPYDとCARDからなるアダプター分子を介してカスパーゼ1を結合する(図3)。NLRC4は、HEK293細胞を用いた遺伝子導入による再構成実験では、ASCを介さずに直接カスパーゼ1に結合し、活性化することができる。しかし、ASC欠損マウスでは黄色ブドウ球菌などによるNLRP3依存性のカスパーゼ1活性化ばかりでなく、サルモネラ菌などによるNLRC4依存性のカスパーゼ1活性化も著名に抑制される6)。従って、ASCはNLRC4を介したカスパーゼ1活性化にも何らかの形で寄与していると考えられる6)。
NLRP3やNLRC4は、HEK293細胞を用いた再構成実験では、カスパーゼ1依存性のIL-1β活性化以外に、細胞死やNF-κBの活性化を誘導することができる。細胞死やNF-κBの活性化もASCを介して誘導される。これらの分子を欠損するマウスに由来するマクロファージは細菌感染によるNF-κBの活性化に異常が認められず、マウスのマクロファージではASCはNF-κBの活性化に必要ではない。しかし、ヒト単球系細胞株であるTHP-1細胞でASCの発現を抑制すると、細菌感染によるNF-κBの活性化とともにTNFαやIL-6の産生が低下することから、少なくともヒトではNLRP3/NLRC4-ASC経路がNF-κBの活性化に働いていると考えられる17)。
我々はHEK293細胞や種々のヒトがん細胞株を用いた遺伝子導入による再構成実験系を用い、ASCはカスパーゼ8の活性化を誘導し、その下流でアポトーシスやNF-κBの活性化が起きることが示した18) 19)。ショウジョウバエではカスパーゼ8のホモログ(DREDD)が細胞表面のペプチドグリカン受容体を介したNF-κBの活性化に重要な役割を果たしていることが知られており、パターン認識受容体を介したNF-κBの活性化におけるカスパーゼ8の役割は、進化的にも保存された重要な役割であると考えられる。
細菌感染によりマクロファージなどが細胞死を起こす現象は良く知られている。マウスのマクロファージを用いた実験では、このような細胞死はカスパーゼ1の活性化により誘導されることが知られており、パイロジェン(IL-1β)の産生と共役したアポトーシス様細胞死と言う意味でパイロトーシスと呼ばれている20)。カスパーゼ1の関与から予想される通り、NLRC4やNLRP3などのNLRがパイロトーシスにも重要な役割を果たしている。一方、ヒト単球様細胞株を用いた実験では、後述する自己炎症性疾患で同定されたNLRP3の機能更新型突然変異体を発現させたり、黄色ブドウ球菌を感染させたりするとネクローシスが誘導される21) 22)。この細胞死はASC依存性であるが、カスパーゼ1阻害剤では阻害されず、カテプシンB阻害剤であるCA-074Meによって強く阻害される。この細胞死にはリソソームの透過性更新が伴うことやVascular
ATPaseの阻害剤によって細胞死が抑制されることから、リソソームが重要な役割を果たしていると考えられているが、ASCからリソソームへのシグナルの流れは分かっていない。また、同じASCの活性化でも細胞によって異なるタイプの細胞死が起きるメカニズムについても不明である。
この他、NLRP1もASC、カスパーゼ1、カスパーゼ5を含む複合体“インフラマゾーム”を形成してIL-1βを活性化することが示されている23)。NLRP1はMDPに応答するという報告もある24)。マウスにはNLRP1aとNLRP1bの2種類のNLRP1が存在するが、いずれもアミノ末端のPYDが無い。NLRP1bのアロタイプは炭疽菌毒素(anthrax lethal toxin)に対するマクロファージの感受性(細胞死)を規定する 25)。炭疽菌毒素感受性のNLRP1bアロタイプを持つマクロファージで、カスパーゼ1を2重に欠損させると感受性が失われることから、NLRP1bはカスパーゼ1依存性の細胞死を誘導していると考えられる。最近、炭疽菌毒素非感受性NLRP1bアロタイプを持つマウスに感受性NLRP1bアロタイプの遺伝子を導入すると炭疽菌感染に抵抗性を獲得する 26)。従って、炭疽菌毒素によるマクロファージの細胞死は、炭疽菌に対する宿主の自然免疫応答と考えられる。
2-3)NAIP
NAIPはアミノ末端にBIRを有し、cIAP1, cIAP2, XIAPなどと共に IAP (inhibitor of apoptosis protein)ファミリーに属する蛋白である。褐色細胞腫由来PC12細胞株にNAIP遺伝子を導入するとアポトーシス抵抗性を獲得する。一型脊髄性筋萎縮症の原因遺伝子であるSurvival of Motor Neuron (SMN)1, SMN2の近傍に存在し、症状が重篤な患者ではSMN1, SMN2に加え、NAIPも欠失している場合が多い27)。マウスではゲノム上に隣接して7種類のNAIP遺伝子が存在する。レジオネラ菌感染に感受性の高い系統のマウスでは、NAIP が欠失しており、NAIP 5遺伝子を導入することでレジオネラ菌抵抗性を獲得する28)。NAIP5を導入したマクロファージはレジオネラ菌の細胞内感染に抵抗性を示す。したがって、NAIPは種々の細胞のアポトーシス抵抗性に寄与していると考えられる。
3. 炎症抑制作用を示すNLR蛋白
上述のNLR蛋白とは逆にNF-κBやカスパーゼ1の活性化を抑制するNLR蛋白も知られている。我々はPYDとNODから成る蛋白PYNOD(NLRP10)を発見した29)。PYNODのPYDやNODはNLRP3のそれらと比較的相同性が高く、当初NLRP3と同様カスパーゼ-1やNF-κBの活性化を誘導する蛋白質と推定したが、HEK293細胞を用いた再構成実験では、むしろASCやカスパーゼ1に対する阻害因子として働くことが判明した。ヒトNLRP2とNLRP7の遺伝子は互いに相同性が高く、ゲノム上に隣接して存在する。また、マウスには両遺伝子に共通のオルソログと考えられる遺伝子が一つしか存在しない。したがって、これらの遺伝子は極最近の遺伝子重複により生じたと考えられる。ヒトNLRP2はASCによるNF-kBの活性化を阻害するが、カスパーゼ1依存性のIL-1b活性化には影響しない。逆に、NLRP7はカスパーゼ1依存性のIL-1b活性化を阻害するが、NF-kBの活性化には影響しない。おそらく、NLRP2とNLRP7はPYNODのように両方の作用をもつ共通の祖先遺伝子から一つずつ機能を受け継いだと思われる30)。NLRP4はIkB kinase (IKK)aに結合し、IKK複合体の活性を阻害することにより、腫瘍壊死因子やIL-1bによるNF-kBの活性化を抑制する31)。NLRP12はNLRP3とアミノ酸配列が非常によく似ている。当初、NLRP3と同様、カスパーゼ1依存性のIL-1β活性化やNF-κBの活性化を誘導する蛋白であると報告された 32)。しかし、NLRP12はNIK(NF-κB-inducing kinase) のプロテアソームにおける分解を促進することでNF-κBの非古典経路を抑制し、ケモカインの産生を抑制するとの報告もある 33)。さらに、NOD2のスプライシングバリアントであるNOD2SもNF-κBの活性化を抑制する作用が報告されている34)。このように、NLR蛋白の中には炎症抑制に働くものも存在すると考えられる。ただし、”炎症抑制型NLR蛋白“の機能に関しては、遺伝子過剰発現実験の結果から示唆されたものであり、今後、生理的な実験系で検証が必要である。
4.NLR蛋白と自己炎症性疾患
4−1)NLRP3、NLRP12と自己炎症性疾患
2001年にHoffmanら35)は家族性寒冷自己炎症性疾患(familial cold
autoinflammatory syndrome, FCAS、別名 家族性寒冷蕁麻疹 familial
cold urticaria, FCU)やマックル-ウェルズ症候群(Muckle-Wells syndrome, MWS)の原因遺伝子としてCIAS1を同定し、そのコードする蛋白質をクリオピリンと命名した。これが現在NLRP3と呼ばれているものである。その後、慢性乳児神経皮膚関節症候群(Chronic infantile neurological cutaneous
and articular syndrome, CINCA、別名neonatal-onset
multisystem inflammatory disease, NOMID)もNLRP3の突然変異を原因とする自己炎症性疾患であることが判明し、これら3つの疾患はCryopyrin-associated Periodic Syndromes (CAPS)と呼ばれている。
FCASはその名の通りほとんどが家族性で、乳幼児期に発症し、低温によって誘発される周期的な発熱発作、蕁麻疹用発作、非感染性結膜炎を特徴とする疾患である。MWSは孤発性が多く、FCASより症状が重く、進行性の難聴を伴うケースが多い。一方、CINCAはほとんどが孤発性で、FCASやMWSと比べ最も症状が重く、持続性の発熱、蕁麻疹、結膜炎に加え、関節炎、無菌性髄膜炎、進行性の聴覚、視覚障害、精神障害などが認められる。
CAPSで認められるNLRP3遺伝子の突然変異はNODからLRRに分布し、機能更新型の突然変異である(図4)。CAPSは世界的にみると100万人に一人の希少疾患で、FCASとMWSはヨーロッパ人に多く見られるが、CINCAは人種に関わりなく存在する。
最近、NLRP3変異の認められないFCASの2家系でNLRP12の突然変異が発見された36)。上述のようにNLRP12はNLRファミリーの中でも、アミノ酸配列がNLRP3と特に類似している。FCASの患者で発見されたNLRP12の突然変異体はいずれもNF-κB活性化を抑制する能力が低下している。しかし、NLRP3の変異の場合と同様、NLRP12変異によるFCASも優性遺伝するのに加え、NF-κBの活性化には様々な制御が働いており、NLRP12の抑制活性が少し低下した程度で疾患につながるという考えには疑問もあり、今後さらに検証される必要がある。
上述のように、NLRP3はカスパーゼ-1を介してIL-1βの成熟と分泌を誘導することから、IL-1βがこれらの疾患の病態形成に関与していることが予想された。そこでCAPSの治療にIL-1βアンタゴニスト(アナキンラ)の投与が行われ、顕著な治療効果を示すことが明らかにされた37) 38)。尿酸結晶がNLRP3を活性化することを既に述べたが、尿酸結晶は痛風の原因物質であることから、最近痛風の治療にもアナキンラが用いられ、少ない症例での検討ではあるが、有効性が報告されている39) 40)。
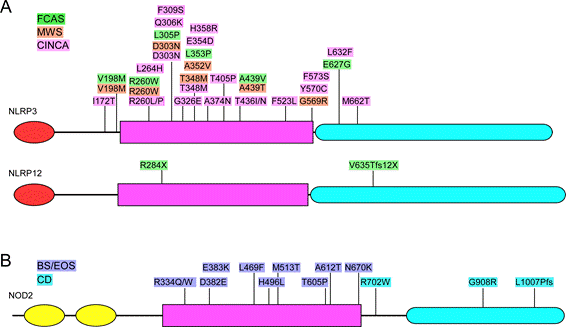
図4. NLRP3, NLRP12, NOD2の突然変異と自己炎症性疾患
A. CAPSで認められるNLRP3の突然変異の多くはNODに集中しているが、一部NODのアミノ末端側近傍とLRR内にも認められる。NLRP12ではNODとLRRに一か所ずつ見つかっている。B. ブラウ症候群、EOSで認められるNOD2の突然変異はNODにに集中している。一方、クローン病で認められるNOD2の突然変異はLRR及びLRR近傍に存在する。
4-2)パイリンと自己炎症性疾患
家族性地中海熱(Familial Mediterranean Fever、FMF)はCAPSと類似の症状を呈する遺伝性周期熱症候群である。実は、CAPSの原因遺伝子CIAS1が同定されるより早い1997年に国際FMF コンソーシアムとフランスFMF コンソーシアムがFMFの原因遺伝子としてMEFVと同定し、この遺伝子がコードする蛋白質をパイリン(Pyrin)と命名した41) 42)。パイリンにはNODやLRRは無く、NLRファミリーのメンバーではないが、NLRP3と関係が深いのでここで紹介する。パイリンはアミノ末端にNLRP3のアミノ末端と相同な領域が存在し、それがPYDの名前の由来である。NLRP3がクリオピリンと呼ばれたのもパイリンの名前に因んだものである。パイリンはNLRP3のシグナル伝達に働くアダプター蛋白質ASCの阻害因子として機能すると言われている43)。逆にパイリンはNLRP3同様、ASCを介してカスパーゼ1依存性のIL-1β活性化に働くという報告もあり44)、今後さらなる検証が必要であるが、CAPSと異なりFMFは劣性遺伝形質であり、炎症誘導因子の機能更新型突然変異が原因と考えるより、炎症抑制因子の機能欠損型変異が原因と考える方が説明しやすい。FMFでも少数の患者の症例報告ではあるがアナキンラの有効性が認められている。
4-3)NOD2と自己炎症性疾患
2001年にMiceli-Richardらはブラウ症候群(Blau syndrome)の原因遺伝子がNOD2であることを発見した45)。ブラウ症候群は乳幼児期にサルコイドーシスを発症する疾患で、家族性の場合をブラウ症候群、孤発性の場合を若年性サルコイドーシス(early onset sarcoidosis, EOS)と分類する場合もあるが、EOSの患者でも同様の突然変異がNOD2遺伝子に認められる46) 47)。ブラウ症候群や若年性サルコイドーシスの患者で見つかるNOD2の突然変異はNOD領域に集中しており(図4)、機能更新型の突然変異である。NOD2の機能更新でなぜサルコイドーシスが発症するのかは不明である。
一方、Oguraら48)、Hugotら49)は、欧米のクローン病(Crohn's disease)の患者ではNOD2遺伝子の特定のフレームシフト突然変異やミスセンスバリアントが見出される頻度が高いことを発見した。これらの突然変異やバリアントは単独ではクローン病を発症させることは出来ず、他の要因と複合的に働いて、クローン病の発症頻度を高める危険因子として作用する。面白いことに、クローン病と関連するNOD2遺伝子の変異やバリアントはLRR領域に集中しており、NOD2の機能は欠損する。これは、NOD2の機能欠損で腸管のマイクロフローラ制御に異常が起き、その結果として慢性的な炎症がおきることがクローン病の素地を作りだすためと解釈できる。ただし、日本や中国などのアジア人のクローン病患者ではNOD2の遺伝型とクローン病の関連は認められていない50)
おわりに
ここまで紹介してきたように、パターン認識受容体として重要な役割を果たしているNLRの突然変異が種々の自己炎症性疾患の原因、素因となっていることが明らかになってきた。このことは、自然免疫系がこの疾患に重要な役割を果たしていることを示唆する。自己免疫疾患は獲得免疫系が自己を攻撃する疾患であるのに対し、自己炎症性疾患は自然免疫系が自己を攻撃する疾患と言えるかも知れない。最近、TLRやNLR以外にも多くのパターン認識受容体が発見されており、それらの突然変異も自己炎症性疾患の原因となるかも知れない。また、NLRP12やパイリンのように炎症抑制に働くことが示唆されている因子の突然変異も自己炎症性疾患の原因となることから、NLRP10を含む炎症抑制性のNLR蛋白の突然変異も自己炎症性疾患の原因となりうる。原因遺伝子が不明の自己炎症性疾患の患者に遭遇したら、これらの遺伝子の変異を疑ってみてはどうだろうか。
文献
1) McDermott, M. F., Aksentijevich, I., Galon, J.,
McDermott, E. M., Ogunkolade, B. W., Centola, M., Mansfield, E., Gadina, M.,
Karenko, L., Pettersson, T., McCarthy, J., Frucht, D. M., Aringer, M., Torosyan,
Y., Teppo, A. M., Wilson, M., Karaarslan, H. M., Wan, Y., Todd, I., Wood, G.,
Schlimgen, R., Kumarajeewa, T. R., Cooper, S. M., Vella, J. P., Amos, C. I.,
Mulley, J., Quane, K. A., Molloy, M. G., Ranki, A., Powell, R. J., Hitman, G.
A., O'Shea, J. J., and Kastner, D. L.: Germline mutations in the extracellular
domains of the 55 kDa TNF receptor, TNFR1, define a family of dominantly
inherited autoinflammatory syndromes. Cell, 1999, 97:133-144
2) Galon, J., Aksentijevich, I., McDermott, M. F., O'Shea,
J. J., and Kastner, D. L.: TNFRSF1A mutations and autoinflammatory syndromes.
Curr Opin Immunol, 2000, 12:479-486
3) Inohara, N., Ogura, Y., Fontalba, A., Gutierrez, O.,
Pons, F., Crespo, J., Fukase, K., Inamura, S., Kusumoto, S., Hashimoto, M.,
Foster, S. J., Moran, A. P., Fernandez Luna, J. L., and Nunez, G.: Host
recognition of bacterial muramyl dipeptide mediated through NOD2. Implications
for Crohn's disease. J Biol Chem, 2003, 278:5509-5512
4) Girardin, S. E., Boneca, I. G., Viala, J., Chamaillard,
M., Labigne, A., Thomas, G., Philpott, D. J., and Sansonetti, P. J.: Nod2 is a
general sensor of peptidoglycan through muramyl dipeptide (MDP) detection. J
Biol Chem, 2003, 278:8869-8872
5) Chamaillard, M., Hashimoto, M., Horie, Y., Masumoto, J.,
Qiu, S., Saab, L., Ogura, Y., Kawasaki, A., Fukase, K., Kusumoto, S., Valvano,
M. A., Foster, S. J., Mak, T. W., Nunez, G., and Inohara, N.: An essential role
for NOD1 in host recognition of bacterial peptidoglycan containing
diaminopimelic acid. Nat Immunol, 2003, 4:702-707
6) Mariathasan, S., Newton, K., Monack, D. M., Vucic, D.,
French, D. M., Lee, W. P., Roose-Girma, M., Erickson, S., and Dixit, V. M.:
Differential activation of the inflammasome by caspase-1 adaptors ASC and Ipaf.
Nature, 2004, 430:213-218
7) Franchi, L., Amer, A., Body-Malapel, M., Kanneganti, T.
D., Ozoren, N., Jagirdar, R., Inohara, N., Vandenabeele, P., Bertin, J., Coyle,
A., Grant, E. P., and Nunez, G.: Cytosolic flagellin requires Ipaf for
activation of caspase-1 and interleukin 1beta in salmonella-infected
macrophages. Nat Immunol, 2006, 7:576-582
8) Miao, E. A., Alpuche-Aranda, C. M., Dors, M., Clark, A.
E., Bader, M. W., Miller, S. I., and Aderem, A.: Cytoplasmic flagellin
activates caspase-1 and secretion of interleukin 1beta via Ipaf. Nat Immunol,
2006, 7:569-575
9) Kanneganti, T.-D., Ozoren, N., Body-Malapel, M., Amer,
A., Park, J.-H., Franchi, L., Whitfield, J., Barchet, W., Colonna, M.,
Vandenabeele, P., Bertin, J., Coyle, A., Grant, E. P., Akira, S., and Nunez,
G.: Bacterial RNA and small antiviral compounds activate caspase-1 through
cryopyrin/Nalp3. Nature, 2006, 440:233-236
10) Kanneganti, T.-D.,
Body-Malapel, M., Amer, A., Park, J.-H., Whitfield, J., Franchi, L.,
Taraporewala, Z. F., Miller, D., Patton, J. T., Inohara, N., and Nunez, G.:
Critical role for Cryopyrin/Nalp3 in activation of caspase-1 in response to
viral infection and double-stranded RNA. J Biol Chem, 2006, 281:36560-36568
11) Harder, J., Franchi,
L., Munoz-Planillo, R., Park, J.-H., Reimer, T., and Nunez, G.: Activation of
the Nlrp3 inflammasome by Streptococcus pyogenes requires streptolysin O and
NF-kappa B activation but proceeds independently of TLR signaling and P2X7
receptor. J Immunol, 2009, 183:5823-5829
12) Craven, R. R., Gao,
X., Allen, I. C., Gris, D., Bubeck Wardenburg, J., McElvania-Tekippe, E., Ting,
J. P., and Duncan, J. A.: Staphylococcus aureus alpha-hemolysin activates the
NLRP3-inflammasome in human and mouse monocytic cells. PLoS One, 2009, 4:e7446
13) Martinon, F.,
Petrilli, V., Mayor, A., Tardivel, A., and Tschopp, J.: Gout-associated uric
acid crystals activate the NALP3 inflammasome. Nature, 2006, 440:237-241
14) Mariathasan, S.,
Weiss, D. S., Newton, K., McBride, J., O'Rourke, K., Roose-Girma, M., Lee, W.
P., Weinrauch, Y., Monack, D. M., and Dixit, V. M.: Cryopyrin activates the
inflammasome in response to toxins and ATP. Nature, 2006, 440:228-232
15) Dostert, C.,
Petrilli, V., Van Bruggen, R., Steele, C., Mossman, B. T., and Tschopp, J.:
Innate immune activation through Nalp3 inflammasome sensing of asbestos and
silica. Science, 2008, 320:674-677
16) Zhou, R., Tardivel,
A., Thorens, B., Choi, I., and Tschopp, J.: Thioredoxin-interacting protein
links oxidative stress to inflammasome activation. Nat Immunol 2009 Dec, 2009,
:20
17) Taxman, D. J., Zhang,
J., Champagne, C., Bergstralh, D. T., Iocca, H. A., Lich, J. D., and Ting, J.
P.-Y.: Cutting edge: ASC mediates the induction of multiple cytokines by
Porphyromonas gingivalis via caspase-1-dependent and -independent pathways. J
Immunol, 2006, 177:4252-4256
18) Hasegawa, M.,
Imamura, R., Kinoshita, T., Matsumoto, N., Masumoto, J., Inohara, N., and Suda,
T.: ASC-mediated NF-kappa B activation leading to IL-8 production requires
caspase-8 and is inhibited by CLARP. J Biol Chem, 2005, 280:15122-15130
19) Hasegawa, M., Kawase,
K., Inohara, N., Imamura, R., Yeh, W.-C., Kinoshita, T., and Suda, T.:
Mechanism of ASC-mediated apoptosis: bid-dependent apoptosis in type II cells.
Oncogene, 2007, 26:1748-1756
20) Cookson, B. T., and
Brennan, M. A.: Pro-inflammatory programmed cell death. Trends Microbiol, 2001,
9:113-114
21) Fujisawa, A., Kambe,
N., Saito, M., Nishikomori, R., Tanizaki, H., Kanazawa, N., Adachi, S., Heike,
T., Sagara, J., Suda, T., Nakahata, T., and Miyachi, Y.: Disease-associated
mutations in CIAS1 induce cathepsin B-dependent rapid cell death of human THP-1
monocytic cells. Blood, 2007, 109:2903-2911
22) Willingham, S. B.,
Bergstralh, D. T., O'Connor, W., Morrison, A. C., Taxman, D. J., Duncan, J. A.,
Barnoy, S., Venkatesan, M. M., Flavell, R. A., Deshmukh, M., Hoffman, H. M.,
and Ting, J. P. -Y.: Microbial pathogen-induced necrotic cell death mediated by
the inflammasome components CIAS1/cryopyrin/NLRP3 and ASC. Cell Host Microbe,
2007, 2:147-159
23) Martinon, F., Burns,
K., and Tschopp, J.: The inflammasome: a molecular platform triggering
activation of inflammatory caspases and processing of proIL-beta. Mol Cell,
2002, 10:417-426
24) Faustin, B.,
Lartigue, L., Bruey, J. M., Luciano, F., Sergienko, E., Bailly-Maitre, B.,
Volkmann, N., Hanein, D., Rouiller, I., and Reed, J. C.: Reconstituted NALP1
inflammasome reveals two-step mechanism of caspase-1 activation. Mol Cell,
2007, 25:713-724
25) Boyden, E. D., and
Dietrich, W. F.: Nalp1b controls mouse macrophage susceptibility to anthrax lethal
toxin. Nat Genet, 2006, 38:240-244
26) Terra, J. K., Cote,
C. K., France, B., Jenkins, A. L., Bozue, J. A., Welkos, S. L., Levine, S. M.,
and Bradley, K. A.: Cutting Edge: Resistance to Bacillus anthracis Infection
Mediated by a Lethal Toxin Sensitive Allele of Nalp1b/Nlrp1b. J Immunol, 2010,
184:17-20
27) Roy, N., Mahadevan,
M. S., McLean, M., Shutler, G., Yaraghi, Z., Farahani, R., Baird, S., Besner
Johnston, A., Lefebvre, C., Kang, X.: The gene for neuronal apoptosis inhibitory
protein is partially deleted in individuals with spinal muscular atrophy. Cell,
1995, 80:167-178
28) Diez, E., Lee, S. H.,
Gauthier, S., Yaraghi, Z., Tremblay, M., Vidal, S., and Gros, P.: Birc1e is the
gene within the Lgn1 locus associated with resistance to Legionella
pneumophila. Nat Genet, 2003, 33:55-60. Epub 2002 De
29) Wang, Y., Hasegawa,
M., Imamura, R., Kinoshita, T., Kondo, C., Konaka, K., and Suda, T.: PYNOD, a
novel Apaf-1/CED4-like protein is an inhibitor of ASC and caspase-1. Int
Immunol, 2004, 16:777-786
30) Kinoshita, T., Wang,
Y., Hasegawa, M., Imamura, R., and Suda, T.: PYPAF3, a PYRIN-containing
APAF-1-like protein, is a feedback regulator of caspase-1-dependent
interleukin-1beta secretion. J Biol Chem, 2005, 280:21720-21725
31) Fiorentino, L.,
Stehlik, C., Oliveira, V., Ariza, M. E., Godzik, A., and Reed, J. C.: A novel
PAAD-containing protein that modulates NF-kappa B induction by cytokines tumor
necrosis factor-alpha and interleukin-1beta. J Biol Chem, 2002, 277:35333-35340
32) Wang, L., Manji, G.
A., Grenier, J. M., Al-Garawi, A., Merriam, S., Lora, J. M., Geddes, B. J.,
Briskin, M., DiStefano, P. S., and Bertin, J.: PYPAF7, a novel PYRIN-containing
Apaf1-like protein that regulates activation of NF-kappa B and
caspase-1-dependent cytokine processing. J Biol Chem, 2002, 277:29874-29880
33) Lich, J. D.,
Williams, K. L., Moore, C. B., Arthur, J. C., Davis, B. K., Taxman, D. J., and
Ting, J. P. -Y.: Monarch-1 suppresses non-canonical NF-kappaB activation and
p52-dependent chemokine expression in monocytes. J Immunol, 2007, 178:1256-1260
34) Rosenstiel, P., Huse,
K., Till, A., Hampe, J., Hellmig, S., Sina, C., Billmann, S., von Kampen, O.,
Waetzig, G. H., Platzer, M., Seegert, D., and Schreiber, S.: A short isoform of
NOD2/CARD15, NOD2-S, is an endogenous inhibitor of NOD2/receptor-interacting
protein kinase 2-induced signaling pathways. Proc Natl Acad Sci U S A, 2006,
103:3280-3285
35) Hoffman, H. M.,
Mueller, J. L., Broide, D. H., Wanderer, A. A., and Kolodner, R. D.: Mutation
of a new gene encoding a putative pyrin-like protein causes familial cold
autoinflammatory syndrome and Muckle-Wells syndrome. Nat Genet, 2001,
29:301-305
36) Jeru, I., Duquesnoy,
P., Fernandes-Alnemri, T., Cochet, E., Yu, J. W., Lackmy-Port-Lis, M.,
Grimprel, E., Landman-Parker, J., Hentgen, V., Marlin, S., McElreavey, K.,
Sarkisian, T., Grateau, G., Alnemri, E. S., and Amselem, S.: Mutations in
NALP12 cause hereditary periodic fever syndromes. Proc Natl Acad Sci U S A,
2008, 105:1614-1619
37) Hawkins, P. N., Lachmann,
H. J., Aganna, E., and McDermott, M. F.: Spectrum of clinical features in
Muckle-Wells syndrome and response to anakinra. Arthritis Rheum, 2004,
50:607-612
38) Hoffman, H. M.,
Rosengren, S., Boyle, D. L., Cho, J. Y., Nayar, J., Mueller, J. L., Anderson,
J. P., Wanderer, A. A., and Firestein, G. S.: Prevention of cold-associated
acute inflammation in familial cold autoinflammatory syndrome by interleukin-1
receptor antagonist. Lancet, 2004, 364:1779-1785
39) So, A., De Smedt, T.,
Revaz, S., and Tschopp, J.: A pilot study of IL-1 inhibition by anakinra in
acute gout. Arthritis Res Ther, 2007, 9:R28
40) Gratton, S. B.,
Scalapino, K. J., and Fye, K. H.: Case of anakinra as a steroid-sparing agent
for gout inflammation. Arthritis Rheum, 2009, 61:1268-1270
41) The French, F.M.F.
C.: A candidate gene for familial Mediterranean fever. Nat Genet, 1997,
17:25-31
42) The International,
F.M.F. C.: Ancient missense mutations in a new member of the RoRet gene family
are likely to cause familial Mediterranean fever. Cell, 1997, 90:797-807
43) Dowds, T. A.,
Masumoto, J., Chen, F. F., Ogura, Y., Inohara, N., and Nunez, G.: Regulation of
cryopyrin/Pypaf1 signaling by pyrin, the familial Mediterranean fever gene
product. Biochem Biophys Res Commun, 2003, 302:575-580
44) Yu, J.-W., Wu, J.,
Zhang, Z., Datta, P., Ibrahimi, I., Taniguchi, S., Sagara, J.,
Fernandes-Alnemri, T., and Alnemri, E. S.: Cryopyrin and pyrin activate
caspase-1, but not NF-kappaB, via ASC oligomerization. Cell Death Differ, 2006,
13:236-249
45) Miceli-Richard, C.,
Lesage, S., Rybojad, M., Prieur, A. M., Manouvrier-Hanu, S., Hafner, R.,
Chamaillard, M., Zouali, H., Thomas, G., and Hugot, J. P.: CARD15 mutations in
Blau syndrome. Nat Genet, 2001, 29:19-20
46) Kanazawa, N.,
Okafuji, I., Kambe, N., Nishikomori, R., Nakata-Hizume, M., Nagai, S., Fuji,
A., Yuasa, T., Manki, A., Sakurai, Y., Nakajima, M., Kobayashi, H., Fujiwara,
I., Tsutsumi, H., Utani, A., Nishigori, C., Heike, T., Nakahata, T., and
Miyachi, Y.: Early-onset sarcoidosis and CARD15 mutations with constitutive
nuclear factor-kappaB activation: common genetic etiology with Blau syndrome.
Blood, 2005, 105:1195-1197
47) Rose, C. D., Doyle,
T. M., McIlvain-Simpson, G., Coffman, J. E., Rosenbaum, J. T., Davey, M. P.,
and Martin, T. M.: Blau syndrome mutation of CARD15/NOD2 in sporadic early
onset granulomatous arthritis. J Rheumatol, 2005, 32:373-375
48) Ogura, Y., Bonen, D.
K., Inohara, N., Nicolae, D. L., Chen, F. F., Ramos, R., Britton, H., Moran,
T., Karaliuskas, R., Duerr, R. H., Achkar, J. P., Brant, S. R., Bayless, T. M.,
Kirschner, B. S., Hanauer, S. B., Nunez, G., and Cho, J. H.: A frameshift
mutation in NOD2 associated with susceptibility to Crohn's disease. Nature,
2001, 411:603-606
49) Hugot, J. P.,
Chamaillard, M., Zouali, H., Lesage, S., Cezard, J. P., Belaiche, J., Almer,
S., Tysk, C., O'Morain, C. A., Gassull, M., Binder, V., Finkel, Y., Cortot, A.,
Modigliani, R., Laurent Puig, P., Gower Rousseau, C., Macry, J., Colombel, J.
F., Sahbatou, M., and Thomas, G.: Association of NOD2 leucine-rich repeat
variants with susceptibility to Crohn's disease. Nature, 2001, 411:599-603
50) Inoue, N., Tamura,
K., Kinouchi, Y., Fukuda, Y., Takahashi, S., Ogura, Y., Inohara, N., Nunez, G.,
Kishi, Y., Koike, Y., Shimosegawa, T., Shimoyama, T., and Hibi, T.: Lack of
common NOD2 variants in Japanese patients with Crohn's disease.
Gastroenterology, 2002, 123:86-91
51) Kastner, D. L.:
Hereditary periodic fever syndromes. Hematology Am Soc Hematol Educ Program,
2005, 2005:74-81