NLRファミリー:細胞質の病原体センサー
免疫と炎症 (先端医学社) 2007 15:583-589
須田 貴司、金沢大学がん研究所・免疫炎症制御研究分野
要旨
NLRファミリーはN末端にシグナル伝達ドメイン、中央にヌクレオチド結合と自己多量体化に必要なドメイン、C末端にロイシンリッチリピートを持ち、ヒトで20種類余り存在する蛋白群である。最近、このメンバーに属するNod1/2、CARD12、クリオピリン、NALP1、NAIPなどが、マクロファージや上皮細胞において細胞質内に進入してきた細菌やウイルスなどの病原体の認識や、自然免疫応答を誘導するシグナル伝達、すなわちカスパーゼ1やNF-kBの活性化に重要な役割を果たしていることが明らかにされつつある。また、種々のNLR遺伝子の突然変異が様々な炎症性疾患と関連している。
はじめに
獲得免疫系は顎を持つ脊椎動物にのみ存在し、遺伝子再構成によって作り出される多様な抗原受容体を用いて、動物個体が経験した病原体の持つ抗原を特異的に識別して攻撃、排除する。これに対し、自然免疫系は植物を含む多くの多細胞生物に広く存在し、生殖細胞のレベルで遺伝的に規定されたパターン認識受容体(pattern recognition receptor)が特定のグループの病原体に共通で特徴的な分子構造(pathogen-associated molecular pattern, PAMP)を認識し、病原体の排除に働く。ここで言う病原体のグループとはグラム陰性菌とか二本鎖RNAウイルスという程度のかなり広いグループである。近年、動物の細胞表面パターン認識受容体であるトル様受容体(TLR)が発見され、その病原体識別機構とそのシグナル伝達機構が急速に明らかにされつつある。これに対し、植物ではR蛋白質と呼ばれる分子群がパターン認識受容体として働くと考えられているが、その多くが哺乳類のアポトーシス誘導遺伝子Apaf-1と相同な領域をもつ細胞質蛋白質である。ところが、最近、ヒトやマウスのゲノム配列の解析から、哺乳類にも植物の細胞質R蛋白質と類似の構造をもつ蛋白が多数(ヒトで20種類以上)存在することが判明した。HUGO Gene Nomenclature
Committeeは、これらの蛋白がヌクレオチド結合領域(nucleotide-binding
oligomerization domain, NOD)とロイシンリッチリピート(leucine-rich
repeats, LRR)を持つことから、TLRをもじってNLRファミリー(Nucleotide-binding domain and leucine rich repeat containing
family)と呼ぶことを提唱している。また、実際に哺乳類のNLRの少なくとも一部はパターン認識受容体として機能していることを示す報告が相次いでなされている。本稿では、これらパターン認識受容体として機能するNLRファミリーメンバーについて、最新の知見を含めて概説する。
1. NLR蛋白のドメイン構造1)
(図1〜5)
NLRファミリーの蛋白質は、中央にATPの結合とホモ多量体化に必要な領域NODをもつが、この領域がApaf-1と相同性を示す。一方、Apaf-1がカルボキシル端にWD40リピートを持つのに対し、NLRファミリーはLRRをもつ。しかし、WD40リピートとLRRは機能的には相同、すなわち通常はApaf-1のWD40リピートがApaf-1の多量体化を抑制し、チトクロムcが結合するとその抑制を解除される制御領域として働いているのと同様、NLRのLRRもリガンドが結合する制御領域と考えられている。アミノ末端は、主に3種類の機能領域のいずれかを持つ。そのうちの2種類はカスパーゼ結合領域(caspase recruitment domain, CARD)とパイリン領域(Pyrin-domain, PYD)で、これらは共にデスドメインスーパーファミリーに属するホモフィリック相互作用(相似のドメイン同士が親和性を持つ)領域である。ちなみにApaf-1のアミノ末端にもCARDが存在し、カスパーゼ9のCARDが結合する。もう一種はバキュロウイルスのアポトーシス阻害蛋白に見られる繰り返し構造(baculovirus inhibitor of apoptosis protein repeat, BIR)で、BIRを持つNLRメンバーであるNAIPはアポトーシス抑制作用を持つことが知られている。この他、アミノ末端に転写活性化領域(activation domain)を持つものや既知のドメイン構造が同定されていないものもある。
2. 病原体認識に関わるNLR
1)Nod1、Nod2 (図1)
Nod1およびNod2はアミノ末端にCARD(Nod2は2つ)を持ち、RICK (RIP-like interacting CLARP
kinase)を介してNF-kBを活性化する2)
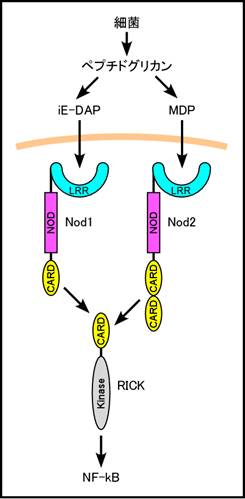
3)。Nod1はカスパーゼ9を活性化してアポトーシスも誘導する2)。Nod1およびNod2は互いに異なるタイプの細菌ペプチドクリカンの部分構造、すなわち各々gD-glutamyl-meso-diaminopimelic acid (iE-DAP)およびmuramyl dipeptide (MDP)を認識することが明らかにされた4)
5)。炎症性腸疾患の一種、クロン病の患者はNod2遺伝子に高頻度に突然変異を持つ6) 7)ことから、Nod2は腸内細菌の制御に重要な役割を果たしている可能性がある。また、Nod2の突然変異はブラウ症候群の原因になる8)。クロン病と相関する突然変異は機能欠損型、ブラウ症候群の原因となる変異は機能亢進型と言われている。
|
図1. Nod1とNod2は、各々 gD-glutamyl-meso-diaminopimelic acid (iE-DAP)とmuramyl dipeptide (MDP)を認識すると、RICKを介してNF-kBの活性化を誘導し、ケモカインや抗菌ペプチドの産生を誘導する。 |
|
2)CARD12 (図2)
IPAF (ICE protease-activating
factor)またはCLAN (CARD, LRR and NACHT domain- containing
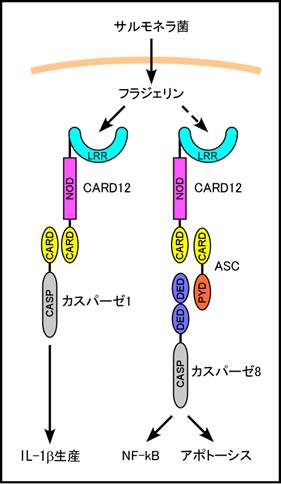
protein)とも呼ばれる。CARD12は、アミノ末端にCARDを持つことから、HUGOはNLRC4 (NLR family, CARD-containing 4)と呼ぶことを提唱している。CARD12はこのCARDを介してカスパーゼ1に結合し、カスパーゼ1を活性化する9) 9)。CARD12はASC (apoptosis-associated speck-like protein containing a CARD)と呼ばれるPYDとCARDから成るアダプター分子とも結合する9)。CARD12とASCは互いのCARDで結合し、さらにASCのPYDにカスパーゼ8が結合することにより、アポトーシスやNF-kBの活性化を誘導する10)。CARD12欠損マウス由来のマクロファージは、リポポリサッカライドなどのトル様受容体を介した刺激によるIL-1b産生は正常に起こるが、サルモネラ菌(Salmonella typhimurium)感染によるカスパーゼ1の活性化とIL-1b産生が起きず、サルモネラ菌感染による細胞死も抑制される11)。また、フラジェリン(細菌鞭毛蛋白)を欠損したサルモネラ菌を野生型マクロファージに感染させてもCARD12依存性のIL-1b産生を誘導できず、精製フラジェリン蛋白をマクロファージ細胞内に導入するとIL-1b産生が誘導されることから、CARD12はフラジェリンを認識してIL-1b産生を誘導する細胞内受容体であると考えられる12) 13)。上述のようにCARD12はASCを介してNF-kBを活性化しうるが、CARD12やASCの欠損マウス由来マクロファージはサルモネラ菌感染によるNF-kB活性化やTNFaの産生は正常である。しかし、ヒトマクロファージ・単球系細胞株THP-1やU937のASCの発現をRNA干渉で抑制すると、歯周病菌ポルフィロモナス・ジンジバリス(Porphyromonas
gingivalis)感染によるNF-kB活性化や種々のサイトカインの産生が抑制されることから14)、ASCはマウスのマクロファージではNF-kB活性化に必要ないが、ヒト細胞では寄与していると考えられる。
|
図2. CARD12はサルモネラ菌などの鞭毛蛋白フラジェリンを認識すると、直接カスパーゼ1を結合して活性化し、IL-1bの産生を誘導する。また、CARD12はASCを介してカスパーゼ8を結合し、アポトーシスやNF-kBの活性化を誘導する。 |
|
3)クリオピリン(Cryopyrin)
(図3)
PYPAF1 (PYD-containing
Apaf1-like protein 1), NALP3 (NACHT, LRR and PYD-containing protein 3), CIAS1
(Cold-induced autoinflammatory syndrome 1)とも呼ばれる。クリオピリンはアミノ末端にPYDを持つことから、HUGOはNLRP3
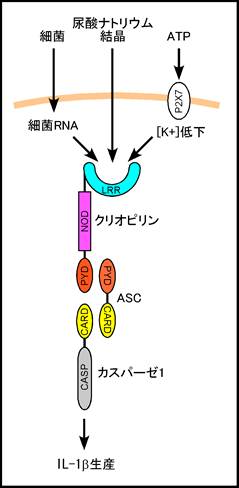
(NLR family, PYD-containing 3)と呼ぶことを提唱している。クリオピリンはASC と互いのPYDで結合し、NF-kBの活性化を誘導する15)。また、ASCのCARDを介してカスパーゼ1を結合、活性化し、IL-1bの産生に寄与する16)。
クリオピリン欠損マウス由来のマクロファージは、グラム陽性菌、陰性菌を含む種々の細菌RNAや二本鎖RNAの刺激によるIL-1b産生がほとんど認められないことから、クリオピリンは細菌RNAやウイルス二本鎖RNAを認識する受容体と考えられる17)
18)。ちなみに同様の条件でマウスのRNAを用いて野生型のマクロファージを刺激してもIL-1b産生は誘導されない。また、クリオピリン欠損マウス由来のマクロファージはサルモネラ菌や野兎病菌(Francisella tularensis)感染によるIL-1b産生は正常におこるが、黄色ブドウ球菌(Staphylococcus aureus)やリステリア(Listeria
monocytogenes)感染によるIL-1b産生が著しく抑制されている19)。前述のように、サルモネラ菌に対するIL-1b産生はCARD12によるフラジェリン認識に大きく依存しており、なぜサルモネラ菌感染時にサルモネラ菌のRNAがクリオピリンを活性化できないのかは不明である。
マウスのマクロファージを様々なTLRリガンドで刺激後、ATPで短時間処理すると、マクロファージはアポトーシスを起こすと同時に大量のIL-1bを放出することが知られている。このATP刺激によるIL-1b産生はその前に刺激を受けるTLRのタイプに関わらずクリオピリン依存性である19)。ATPはP2X7受容体を介して細胞内カリウムイオン濃度を低下させるが、ATPの変わりにカリウムイオノフォアnigericinを用いても同様の結果が得られることから、細胞内カリウムイオンの低下がクリオピリン依存性のカスパーゼ1活性化を誘導するものと考えられる。しかし、その詳細なメカニズムは不明である。また、IL-1bの産生には事前のTLR刺激が必要であるが、カスパーゼ1の活性化にはTLRもMyd88も必要ないことから、TLR刺激はpro-IL-1bの蓄積に必要なのであり、ATP刺激によるクリオピリンを介したカスパーゼ1活性化はTLRシグナル伝達とは独立した応答であると考えられる。
面白いことにクリオピリン欠損マウスのマクロファージは尿酸ナトリウム結晶によるIL-1b産生も起こらない19)。このことから、クリオピリンは痛風の発症にも関与している可能性がある。
|
図3. クリオピリンはASCを介してカスパーゼ1を結合し、活性化する。クリオピリンは細菌RNAや痛風の原因となる尿酸ナトリウム結晶によるIL-1b産生に必須である。また、ATP刺激による細胞質カリウムイオン濃度の低下によるカスパーゼ1の活性化もクリオピリン依存性である。 |
|
クリオピリンの突然変異はfamilial
cold autoinflammatory syndrome (FCAS)やMuckle-Wells
syndrome (MWS)、Chronic infantile neurologic cutaneous
and articular (CINCA) syndromeなどの遺伝性炎症性疾患の原因となる。このような突然変異はNODやLRRに点変異や欠失があり、機能亢進型の変異である。
4)NALP1(図4)
CARD7, DEFCAP (Death effector
filament-forming CED4-like apoptosis protein)とも呼ばれる。NALP1の遺伝子はヒトでは1つ、マウスでは3つ(Nalp1a-c)知られている。ヒトNALP1はアミノ末端にPYDを持つほかに、LRRよりさらにカルボキシル末端側にCARDをもつ。HUGOはNLRP1と呼ぶことを提唱している。しかし、マウスNalp1は3つともアミノ末端のPYDが同定されていない。Nalp1aとNalp1bはカルボキシル端のCARDは持つが、Nalp1cにはこのCARDもない。
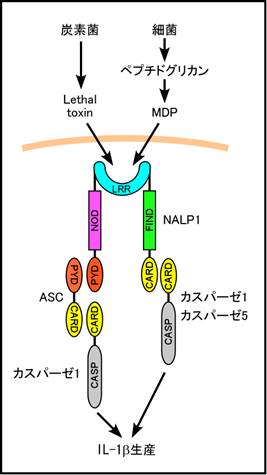
ヒトNALP1はPYDにはASCを介してカスパーゼ1、CARDにはカスパーゼ5を結合して、IL-1βの活性化を誘導するとされている20)。CARDにもカスパーゼ1が結合するという説もある20)。また、ヒトNALP1はPAMPとしてMDPを認識すると報告されている20)。
炭素菌のlethal toxin (LT)に対するマウスの感受性は、第11染色体に単一、優性の遺伝座に支配されていることが知れらていた。最近、この責任遺伝子はNalp1bであることが示された20)。Nalp1bには5つの遺伝子型が存在し、その内、129S1/SvImJマウスなどが持つ遺伝子型とCAST/EiJマウスがもつ遺伝子型の2種類がマクロファージのLT感受性形質を優勢に付与する。LT感受性遺伝型を持つマウスでも、カスパーゼ1遺伝子を欠損させるとマクロファージがLT抵抗性になることから、Nalp1bはLTを認識し、カスパーゼ1を強く活性化することでマクロファージの細胞死を誘導するものと考えられる。
|
図4. ヒトNALP1はアミノ末端のPYDにASCを介してカスパーゼ1を結合し、カルボキシル末端のCARD領域にカスパーゼ1または5を結合し、インフラマゾームと呼ばれる複合体を形成し、IL-1bの産生を誘導する。ヒトNALP1はMDP刺激に応答すると報告されている。一方、マウスNalp1bは炭素菌のlethal toxinに対するマクロファージ感受性に関与する。 |
|
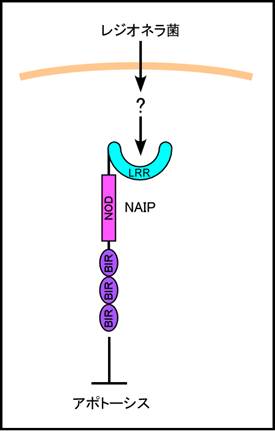
5)NAIP (neuronal apoptosis inhibitory protein 1)(図5)
BIRC1 (Baculoviral IAP
repeat-containing protein 1)とも呼ばれる。NAIPはアミノ末端にバキュロウイルスIAPリピート(BIR)を有し、cIAP1,
cIAP2, XIAPなどと共に IAPファミリーにも属する蛋白である。褐色細胞腫由来PC12細胞株にNAIP遺伝子を導入するとアポトーシス抵抗性を獲得する21)。ヒトNAIP遺伝子は1種類しかないが、マウスではゲノム上に隣接して7種類のNaip(Naip1-7)遺伝子が存在する。レジオネラ菌感染に感受性の高い系統のマウスでは、Naip遺伝子 が欠失しており、Naip5遺伝子を導入することでレジオネラ菌抵抗性を獲得する22)。Naip5を導入したマクロファージはレジオネラ菌の細胞内感染に抵抗性を示す。したがって、NAIPはレジオネラ菌のPAMPを認識し、感染マクロファージのアポトーシス抵抗性に寄与していると考えられる。
ヒトNAIP遺伝子は、一型脊髄性筋萎縮症の原因遺伝子であるSurvival of Motor Neuron (SMN)1, SMN2の近傍に存在し、症状が重篤な患者ではSMN1, SMN2に加え、NAIPも欠失している場合が多い23)。
|
図5. NAIPはアミノ末端にBIRを持ち、アポトーシス抑制作用を持つ。Naip5を欠損するマウスはレジオネラ菌に感受性が高いことから、Naip5はレジオネラ菌由来のPAMPを認識し、アポトーシス抵抗性を付与する因子であると考えられる。 |
|
おわりに
これまで報告されているNLRファミリーの認識するPAMPはTLRの認識するPAMPと共通の分子が多いことは意外に思われるかもしれない。しかし、獲得免疫系の抗原受容体と比べると多様性の限られたパターン認識受容体で多種多様な病原体に対する防御をカバーするには、一つの受容体でかなり広い範囲の病原体をカバーしなければならない。したがって、PAMPはホスト側には存在せず、しかも病原体の大きなグループに共通して存在する分子でなければならず、そのような条件を満たせる分子はそれ程多くないのかもしれない。そのように考えれば、TLRとNLRが共通の分子をPAMPとして認識するのも理解できる。
NLRファミリーのメンバーにはCARD12、クリオピリン、NLRP1のようにカスパーゼ1の活性化を介してIL-1bやIL-18などの炎症性サイトカインの蛋白切断による成熟を誘導できるものが多数存在する。これは、NRLファミリーがApaf-1と類似の構造をもつことと無関係ではないであろう。実際、Apaf-1はチトクロムcとATPの存在下でアポプトゾームと呼ばれる複合体を形成し、カスパーゼ9の多量体化を誘導して活性化するが、一部のNLR蛋白はPAMPとATPの存在下でインフラマゾームを形成し、カスパーゼ1を活性化することが示されている。これまで不明な点が多かったIL-1b産生機構の一部が解明されつつある。今回は、紙面の都合で病原体を認識し、炎症応答を誘導すると考えられるNLRファミリーメンバーについてのみ紹介したが、まだ機能が良く分かっていないNLR蛋白が沢山存在する。我々は、そのようなNLRファミリーのメンバーの中には炎症抑制に働くものも存在すると考えている。このような炎症抑制性のサブファミリーの役割の解明が今後の研究の一つの焦点になると思われる。
文献
1)
須田貴司: Apaf-1様蛋白質:炎症と細胞死の新しい接点. 細胞工学 24:929-933, 2005
2)
Inohara N et al: Nod1, an Apaf-1-like activator of caspase-9 and nuclear
factor-kappaB. J. Biol. Chem. 274:14560-14567, 1999
3)
Ogura Y et al: Nod2, a Nod1/Apaf-1 family member that is restricted to
monocytes and activates NF-kappaB. J.
Biol. Chem. 276:4812-4818, 2001
4)
Chamaillard M et al: An essential role for NOD1 in host recognition of
bacterial peptidoglycan containing diaminopimelic acid. Nat. Immunol. 4:702-707,
2003
5)
Inohara N et al: Host recognition of bacterial muramyl dipeptide mediated
through NOD2. Implications for Crohn's disease. J. Biol. Chem. 278:5509-5512,
2003
6)
Ogura Y et al: A frameshift mutation in NOD2 associated with susceptibility to
Crohn's disease. Nature 411:603-606, 2001
7)
Hugot J P et al: Association of NOD2 leucine-rich repeat variants with
susceptibility to Crohn's disease. Nature
411:599-603, 2001
8)
Miceli Richard C et al: CARD15 mutations in Blau syndrome. Nat Genet 29:19-20, 2001
9)
Geddes B J et al: Human CARD12 is a novel CED4/Apaf-1 family member that
induces apoptosis. Biochem Biophys Res
Commun 284:77-82, 2001
10) Hasegawa M et al: ASC-mediated NF-kappa
B activation leading to IL-8 production requires caspase-8 and is inhibited by
CLARP. J. Biol. Chem. 280:15122-15130, 2005
11) Mariathasan S et al: Differential
activation of the inflammasome by caspase-1 adaptors ASC and Ipaf.. Nature 430:213-218, 2004
12) Miao EA et al: Cytoplasmic flagellin
activates caspase-1 and secretion of interleukin 1beta via Ipaf.. Nat Immunol 7:569-575, 2006
13) Franchi L et al: Cytosolic flagellin
requires Ipaf for activation of caspase-1 and interleukin 1beta in
salmonella-infected macrophages.. Nat
Immunol 7:576-582, 2006
14) Taxman DJ et al: Cutting edge: ASC
mediates the induction of multiple cytokines by Porphyromonas gingivalis via
caspase-1-dependent and -independent pathways.. J Immunol 177:4252-4256,
2006
15) Manji G A et al: PYPAF1, a
PYRIN-containing Apaf1-like protein that assembles with ASC and regulates
activation of NF-kappa B. J. Biol. Chem.
277:11570-11575, 2002
16) Wang L et al: PYPAF7, a novel
PYRIN-containing Apaf1-like protein that regulates activation of NF-kappa B and
caspase-1-dependent cytokine processing. J.
Biol. Chem. 277:29874-29880,
2002
17) Kanneganti TD et al: Critical role for
Cryopyrin/Nalp3 in activation of caspase-1 in response to viral infection and
double-stranded RNA.. J Biol Chem 281:36560-36568, 2006
18) Kanneganti TD et al: Bacterial RNA and
small antiviral compounds activate caspase-1 through cryopyrin/Nalp3.. Nature 440:233-236, 2006
19) Mariathasan S et al: Cryopyrin activates
the inflammasome in response to toxins and ATP.. Nature 440:228-232, 2006
20) Martinon F et al: The inflammasome: a
molecular platform triggering activation of inflammatory caspases and
processing of proIL-beta. Mol. Cell. 10:417-426, 2002
21) Gotz R et al: The neuronal apoptosis
inhibitory protein suppresses neuronal differentiation and apoptosis in PC12
cells.. Hum Mol Genet 9:2479-2489, 2000
22) Diez E et al: Birc1e is the gene within
the Lgn1 locus associated with resistance to Legionella pneumophila. Nat Genet 33:55-60. Epub 2002 De, 2003
23) Roy N et al: The gene for neuronal
apoptosis inhibitory protein is partially deleted in individuals with spinal
muscular atrophy. Cell 80:167-178, 1995