Fas/Fasリガンド系の機能異常による自己寛容破綻のメカニズム
(Failure inself-tolerance by malfunction of the Fas/Fas ligand
system)
(Molecular Medicine
(1995) Vol.32 No.12p1260-1266
キーワード:Fasリガンド、アポトーシス、lpr、gld、自己免疫疾患、SLE、ALPS、T細胞
はじめに
Fasリガンドは主に活性化T細胞に発現し、細胞表面受容体Fasを介し細胞にアポトーシスを引き起こすサイトカインである(1)。我々はFasおよびFasリガンド遺伝子を単離すると同時に(2, 3)、SLE型自己免疫疾患のモデル実験動物として知られるlpr (lymphproliferation)
およびgld (generalized
lymphoproliferative disease) 突然変異マウスが、各々FasおよびFasリガンド遺伝子の突然変異体であることを示した。これらの変異遺伝子のいずれかをホモで持つマウスは、異常T細胞の蓄積による著しいリンパ節腫を引き起こし、抗DNA抗体やリューマチ因子などの自己抗体を産生する。最近、これらのマウスと非常によく似た症状を示す一群の自己免疫疾患の患者で、Fas遺伝子の突然変異が発見された(4, 5)。これらのことから、Fas/Fasリガンドシステムは、免疫系のホメオスタシスや自己寛容の成立に重要な役割を果たしていると考えられる。ここでは、Fas、Fasリガンドの構造とlprやgldマウスの解析などから明らかになったFas、Fasリガンド系の果たす免疫系における役割について現時点の知見を紹介し、Fas、Fasリガンド系の異常がどのようにして自己寛容の破綻につながるのかを考察する。
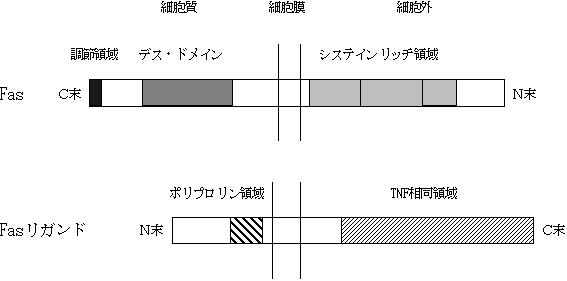
1. FasとFasリガンドの構造
Fasは分子量約45kDのTNF受容体ファミリーに属するI型膜貫通蛋白である(2)。このファミリーの構造上の特徴は、細胞外領域に存在するシステイン残基に富むドメインの繰り返し構造で、Fasは3つの繰り返し構造を待っている(図1)。また、FasとタイプITNF受容体の細胞質領域には約70アミノ酸にわたり有為な相同性を示す領域が存在する。この領域が両分子の細胞傷害機能に重要などメインであるとことから(6, 7)、デスドメイン(death domain)と命名した。最近、FasとタイプITNF受容体のデスドメインに結合する蛋白質のcDNAが酵母ツーハイブリッド( yeast two hybrid) 法により次々と単離された(8-11)。驚いたことに、これらの蛋白質にもデスドメインのモチーフが発見された。従って、デスドメインはアポトーシス信号の細胞内伝達に関わる蛋白同士の結合に関与する構造であると考えられる。Fasを介したアポトーシスにおいても、その他のアポトーシスと同様、ICE(Interleukin-1
Conberting Enzyme) ファミリーに属するプロテアーゼの活性化がキーとなるイベントとなっているようである(12, 13)。従って、デスドメインファミリーとICE ファミリーの間を繋ぐものがなんであるかを検索することが現時点での大きな課題の一つである。
|
図1. FasおよびFasリガンドの構造 |
一方、FasリガンドはN型糖鎖を含む分子量約 40kDのII型膜貫通蛋白質である(3, 14)。細胞外領域には、TNF, LT (lymphotoxin) などと顕著な相同性を示す領域が存在し、FasリガンドがTNFファミリーの一員であることが明らかになった(図1)。細胞質領域は約80アミノ酸からなり、極めてプロリンに富んでいるが、その機能は不明である。また、FasリガンドのTNF相同領域は、TNFaのそれと同様、蛋白分解酵素により切り出され、可溶型Fasリガンドとして分泌される。ヒトでは、この可溶型Fasリガンドも細胞傷害活性を保持している。
2. Fas、Fasリガンド遺伝子の突然変異と免疫異常
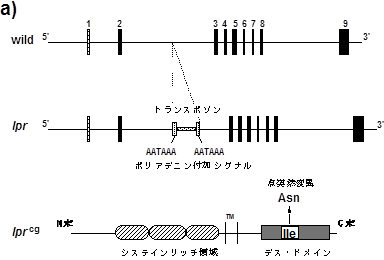
lprとgldは、ともに自然発生した劣性突然変異で、これらの変異遺伝子をホモで持つマウスは、生後数か月で、CD4もCD8も発現していないポリクローナルな異常T細胞が蓄積し、リンパ節腫や脾腫を引き起こす(15)。また同じ時期に、抗DNA抗体などの自己抗体の産生が起こり、マウスの系統によってはSLE様の自己免疫疾患を発症する。しかし、lprとgld変異遺伝子には相補性がなく(言い換えればlprとgld変異遺伝子を共にへテロで持つマウスは野生型の表現形質となる)、lprとgldは別々の遺伝子の突然変異であることが明らかにされていた。ところで、マウスFas遺伝子は19番染色体にマップされが(16)、同じ位置にlpr 遺伝子がマップされていた。そこで、lpr マウスのFas遺伝子の構造を解析したところ、lpr ではFas遺伝子の第2イントロンにeary transposon (ETn) の挿入があり、機能的なFas mRNAの発現が著しく低下していることが明かとなった(17)(図2)。また、lpr と相同遺伝子の突然変異で、lpr と同様の異常をきたすlprcg突然変異遺伝子では、Fas遺伝子の細胞質領域コードするエクソン9 にイソロイシンをアスパラギンに置換するpoint mutationが存在し、このためFasの細胞死誘導活性が著しく減弱していることが示された(18)。
|
|
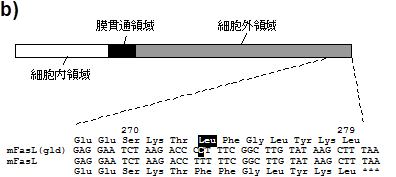
一方、gldはFasリガンドの突然変異である可能性が考えられた。そこで、マウスFasリガンド遺伝子の座位を決めたところ、1番染色体のAt3 近傍に存在することが判明した(19)。これはWatsonらによってマップされたgldの遺伝子座位と一致した。さらに野生型とgld マウスのFasリガンド遺伝子を比較したところ、サザンやノザンハイブリダイゼーション法による解析では、差異が認められなかったが、gld 由来のFasリガンドcDNAにはコーデイング領域3'末近傍にチミジンからシトシンへの置換が存在し、結果として、gld 型FasリガンドはC末端から7番目のフェニルアラニンがロイシンに置換されることが判明した(図2)。さらに、正常Fasリガンドを発現したCOS7細胞がFasを発現した標的細胞にアポトーシスを誘導したのに対し、gld 型Fasリガンドを発現したCOS7細胞は全くその活性を示さなかった。このようにgld突然変異はFasおよびFasリガンド遺伝子の"loss of funnctionmutation" であることが明らかになった。
lpr遺伝子は、その構造から推定されるように、leaky mutationであるという報告が相次いだ。またlprcgとgld遺伝子もpoint mutationであることから、僅かに生理活性が残存している可能性を否定できない。そこで、我々はFas遺伝子のノックアウトマウス(Fas-KO マウス)を作製した。Fas-KOマウスでは、lprの異常を最も強く発現するMRL lpr/lpr
マウスと比較しても、異常T細胞の蓄積、自己抗体の産生とも、さらに加速されていることが判明した (足立ら、投稿中)。
最近、F.Rieux-Laucat らとG. H. Fisherらが独立に、リンパ球の異常増殖を伴う自己免疫疾患の患者でFas遺伝子に突然変異が存在する計8例7家族について報告した(4, 5)。Fisherらはこの一群の疾患を、AutoimmuneLymphoproliferative Syndrome (ALPS) と名付けている。これらの患者では、末梢血中のCD3+CD4-CD8-
細胞が著明に増加していることなど、lprマウスでみられるものと極めて類似した異常を示すことから、Fas、Fasリガンドシステムが、ヒトでも免疫系のホメオスタシスや自己寛容に重要な役割を果たしていることが明らかになった。
3. Fas、Fasリガンド系の異常による自己寛容破綻のメカニズム
lprマウスの胸腺を新生児期に切除してしまうと、リンパ節腫も自己抗体の産生も抑制される(20)。従って、このマウスにおける自己寛容の破綻はT細胞のレベルで起こっていると考えられる。自己反応性T細胞は、胸腺におけるネガティブセレクションにより、まず大部分がアポトーシスを起こして除かれる。さらに抹消にもれ出たものは、やはりアポトーシスを起こして除かれると考えられている。Fas、Fasリガンド系はT細胞自己寛容のどの段階に関与しているのであろうか。Fasが胸腺で強く発現していることから、まずFasが胸腺でのネガティブセレクションに関与している可能性が検討された。その結果、lprやgldマウスでは胸腺ネガティブセレクションがほぼ正常に起こっていることが示され、Fasはネガティブセレクションに必須ではないとされた(21, 22)。我々は、Fas-KOマウスでもこの結果を確認した (足立ら、投稿中)。すなわち、lprやgldマウスでネガティブセレクションが正常なのは、FasやFasリガンドの活性が残存しているためではない。しかし、マウス胸腺細胞の種々のサブセットのFasの発現とアゴニスティックな抗Fas抗体に対する感受性を検討したところ、Fasは未熟なCD4+CD8+ダブルポジティブ (DP) 細胞と成熟したCD4+CD8-およびCD4-CD8+シングルポジティブ (SP) 細胞に発現しているが、抗Fas抗体で細胞死が誘導されるのはDP 細胞のみであった(23)。DP 細胞がセレクション前の細胞であり、SP細胞がセレクション後の細胞であることを考え合わせると、上述の結果は、Fasが胸腺におけるセレクションに関わっているいう’ハイポセシス’と非常に良く合致する。従って、筆者らはネガティブセレクションには複数のメカニズムが重複して関与しており、Fas、Fasリガンド系がその一つを担っているという可能性も捨てきれないと考えている。
以上はマウスの話であるが、ヒトでは少し事情が 異なる。まず、ヒト胸腺細胞でのFasの発現量は、最も未熟なCD4-CD8-ダブルネガティブ(DN) 期からDPにかけ弱く発現し、DPからSPに成熟する過渡期の、TCRの発現レベルが高まり、CD69を発現する細胞集団のみが強く発現し、さらにSPは殆ど発現していないと報告されている(24, 25)。Fasを強く発現する細胞集団は、まさにセレクションを受けていると考えられている細胞集団と一致する。また、米原らはヒト胸腺組織培養系を用い、スーパー抗原であるSEBによるVb3陽性胸腺細胞の特異的な消失が、アンタゴニスティックな抗Fas抗体により抑制されることを示し、ヒトではFasがネガティブセレクションにエッセンシャルな役割を果たしていると結論している。
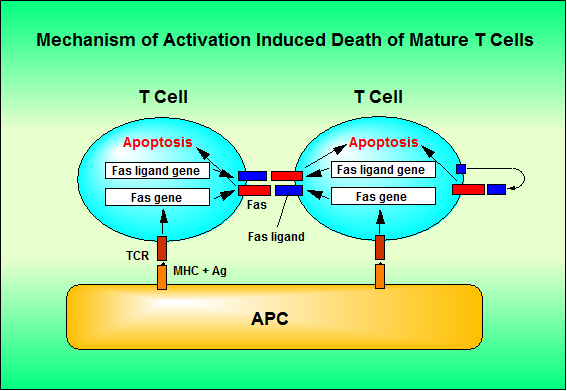
一方、lprやgldマウスにおいて、抹消T細胞が活性化刺激によるアポトーシス、いわゆる activation induced cell death (AICD) を引き起こし難いことがin vitro や in vivoの実験系で明らかにされてきた(22, 26, 27)。前述のALPS患者の末梢血T細胞も正常人のそれに比べてAICDを起こしにくいと報告されている。AICDの細胞レベルでの機構のモデルを図3に示した。T細胞は抗原提供細胞上の抗原/MHC複合体を認識することにより活性化され、FasとFasリガンドの両方を発現すると考えられる。同時に抗原提供細胞上で複数の活性化T細胞が会合することにより、互いに殺し合うと考えられる。また、FasとFasリガンドの両方を発現したT細胞は自分で自分を殺す(オートクライン)ことができるという報告もある(28)。しかし、活性型の可溶性Fasリガンドが産生される場合には、この二つを分けて考える意味は余りない。
以上の結果から、Fas/Fasリガンド系が働かなくなると、末梢で活性化された自己反応性T細胞が排除されずに、自己反応性B細胞の成熟や抗体産生を促すと想像される。すなわちこれが自己寛容が破綻する原因と考えられる。ただし、ほとんどの上述の実験では、非自己抗原や非特異的なマイトーゲンがT細胞を活性化するために使われており、AICDを末梢における自己反応性T細胞の除去のためのメカニズムと考えてよいのかは疑問であるという議論がある。またその場合、AICDでどのようにして自己反応性T細胞と非自己反応性T細胞を区別するのかという点がよく問題にされる。これらの問題は、自己反応性であれ非自己反応性であれ、T細胞が強い抗原刺激を長期間受け続けるならば、そのT細胞はFas/Fasリガンドを介したAICDによって排除され、寛容が成立すると考えれば回避できる。
|
|
おわりに
Fas、Fasリガンド系の異常がどのようにして自己寛容の破綻につながるのか、ここでは現時点での仮説を述べた。しかし、末梢の自己反応性T細胞がどの程度存在し、どの様にその他のT細胞と識別され、どこで除かれているのかなど未解決の問題点が多く残されている。一方、紙面の制約があり、ここでは触れなかったが、最近B細胞のアポトーシスにもFasが関与していることも明らかになっている。lprやgldマウスで起こる自己免疫疾患が自己抗体産生にもとづくものであることから、Fas、Fasリガンド系は自己反応性B細胞の除去にも関与している可能性が大きい。Rathmellらは最近の論文で、アナジーに落ちいった自己反応性B細胞がFas-Fasリガンドを介してヘルパーT細胞により除去されていることを非常に巧妙な実験系で示しており(29)、興味深い。