細胞死の起源
須田貴司 金沢大学がん進展制御研究所 免疫炎症制御研究分野
(日本免疫学会ニュースレター 2015年、Vol.23, No.2, 投稿記事より)
我々の体を構成する細胞は、必要に応じて死ぬように自爆プログラムを内蔵している。では、何故細胞は「死ぬ機能」を獲得したのだろうか。今回は、このプログラム細胞死の起源について考えてみたい。
プログラム細胞死という言葉は、今では「自爆プログラムの発動による細胞死」くらいの広い意味で用いられるが、元は発生過程で特定の時期に特定の細胞が死ぬ現象を指していた。Horvitzらが線虫の発生過程のプログラム細胞死の遺伝学的な研究でノーベル賞を受賞したのも、このことと無関係ではないだろう。彼らの一連の研究から明らかになった線虫のアポトーシスの分子機構は哺乳類でも比較的良く保存されている。では、プログラム細胞死は多細胞生物において個体発生の過程で不要な細胞を取り除く為に生じたのだろうか。恐らく細胞死の起源はもっと遡ることが出来る、というのが私の考えである。
個体発生のプログラム細胞死では、大量に細胞が死んでも炎症は起きない。このため、長い間アポトーシスは炎症を誘導しない細胞死と言われていた。ところが、代表的なデス因子であるFasリガンドは、様々な炎症性サイトカインの産生を誘導し、生体内では好中球の激しい浸潤を伴う炎症を誘導する。別のデス因子であるTNFはそれ自身が代表的な炎症性サイトカインでもある。また、アポトーシスと炎症のシグナル伝達に関わる蛋白の多くに、デスドメインスーパーファミリー{DSF、具体的にはデスドメイン、デスエフェクタードメイン、カスパーゼリクルートメントドメイン(CARD)、パイリンドメイン(PYD)}と呼ばれる同種親和性蛋白間相互作用に働くドメイン構造が共通して見出される。
これらのことを総合すると、アポトーシスと炎症は元々共通の生体防御機構から相互に密接に関連しながら発達したものであり、アポトーシスは炎症を積極的に誘導する外因性経路(デス因子などによる誘導されるアポトーシス経路)と炎症を誘導しない内因性経路(発生過程のアポトーシス経路)に分かれて発達してきたものと考えても良いように思われる。
では、アポトーシスと炎症の共通の起源とはどのようなものだったのか。細胞死と免疫・炎症応答の制御に働くNLRファミリーと呼ばれる分子群が、この疑問に対するヒントを与えてくれる。
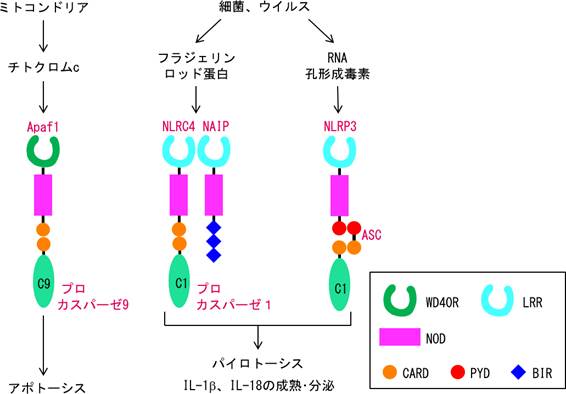
NLRファミリーに属するNLRP3やNLRC4はマクロファージなどに発現し、細菌やウイスルが感染するとカスパーゼ1を活性化する(図)。活性化したカスパーゼ1はプロIL-1βやプロIL-18を成熟型に転換して炎症を誘導すると同時に、パイロトーシスと呼ばれる形態的にはネクローシスに似たプログラム細胞死を誘導する。パイロトーシスは細胞内寄生細菌やウイルスに乗っ取られたマクロファージが、病原体の繁殖を阻止するために起こすプログラム細胞死で、自然免疫応答の一部と考えることができる。
ところで、NLRファミリーに属する多くの分子はN末端にDSFドメイン、中央にヌクレオチド結合多量体化ドメイン(NOD)、C末端にロイシンリッチリピート(LRR)を持っている(図)。このドメイン構成は、内因性アポトーシス経路でミトコンドリアから放出されたチトクロムcを認識し、カスパーゼ9を活性化するApaf-1(CARD-NOD-WD40リピート)と良く似ている。ミトコンドリアは太古の昔に真核細胞の祖先(恐らく単細胞生物)に寄生していた細菌のようなものだったと考えると、アポトーシスの起源も、真核細胞の祖先がミトコンドリアの祖先に寄生された際に、種の保存のために自殺する応答であったと考えると合点がいく。また、プログラム細胞死と自然免疫応答が共通の起源を持つと考えれば、プログラム細胞死は炎症を誘導するのが普通で、内因性経路のアポトーシスの方が、炎症を誘導しないように進化した特殊な細胞死ということになる。
NLRファミリーと良く似た分子群は植物にも存在し、それらは植物の病原体抵抗性に関わる遺伝子群によってコードされる蛋白として発見されている。植物の感染防御の基本様式が、感染細胞が死んで硬い細胞壁で病原体を封じ込めてしまうというものであることを考えると、NLRファミリーは植物でも動物と類似の機能を果たしている可能性が高い。このことも、細胞死の起源が動物と植物が分かれるより以前まで遡れることを示しているのではないだろうか。
図)アポトーシスとパイロトーシスのシグナル伝達機構の類似性