�V�����A�|�g�[�V�X����NJ֘A�`���Q�ANLR�t�@�~���[�̌���
�ŋ�apoptotic protease-activating factor (Apaf)-1�Ɨގ��̍\��������20��ނ��z���`��������������A����炪���ǂƃA�|�g�[�V�X�̗U�����ɓ������q�ł��邱�Ƃ����炩�ɂȂ��Ă��Ă���(�{�c�M�i�A�זE�H�w24���X�� 2005)�B�����̒`���͕��q�����Ɋj�_�����̈�iNucleotide-binding domain�j�A�J���{�L�V�����[�Ƀ��C�V�����b�`�E���s�[�g�̈�������Ƃ���ANLR�t�@�~���[�ƌĂ�Ă���B���Ȃ��Ƃ��ꕔ��NLR�`���̓g���l��e�̂̂悤�ɕa���̂ɓ����I�ȕ��q�\���iPAMP�j��F�����A���R�Ɖu�̊������ɓ����Ă���ƍl�����Ă���B�Ⴆ�ANod1��Nod2�͍ۃy�v�`�h�N���J���̕����\����F�����ANF-��B�̊�������U�����A���R�Ɖu�n�̊������ɓ����Ă���B�܂��ANALP3
(Cryopyrin, PYPAF1), NLRP1 (NALP1), NLRC4 (CARD12, Ipaf, CLAN)�Ȃǂ�ASC�ƌĂ��A�_�v�^�[�`���Ƌ������ăJ�X�p�[�[�P�����������AIL-1���`���̐��n�E�����U������BASC�͍זE����NF-��B�̊������Ɋ�^����B��X�́AASC�����A�|�g�[�V�X��NF-��B�̊������̗����ɃJ�X�p�[�[�W���d�v�Ȗ������ʂ����Ă��邱�Ƃ�����(Hasegawa
et al. J. Biol. Chem. 2005)�B�܂��A�J�X�p�[�[�P������זE�ł́AASC�̊������ɂ���ăl�N���[�V�X�l�̍זE�����N���邱�ƁA���̎��J�X�p�[�[1�̒`�������y�f�Ƃ��Ă̊����͕K�v�Ȃ����ƂȂǂ𖾂炩�ɂ����iMotani et al. J. Biol.Chem.
2011�j�B
�܂��A��X��PYNOD �i�ʖ�NLRP10�j�Ɩ��t�����V����NLR�`���������B���̒`���̓��C�V�����b�`�E���s�[�g�̈�������Ȃ����j�[�N��NLR�`���ŁA�זE�ɉߏ蔭��������ƁA�J�X�p�[�[�P��ASC�ƌ������AIL-1���`���̐��n�E����ANF-��B�̊������A�A�|�g�[�V�X��}������@�\������(Wang
et al. Int. Immunol. 2004)�B�܂��APYNOD�g�����X�W�F�j�b�N�}�E�X�ł́A�ۊ����Ȃǂɂ��}�N���t�@�[�W��IL-1���Y���\���ቺ���A�v���ʂ̃��|�|���T�b�J���C�h�i�ۓ��őf�j�̕��o�����^�ɑ���R�����������Ƃ𖾂炩�ɂ����iImamura et al.
J. Immunol. 2010�j�B��X�́ANLRP7 (PYPAF3)���J�X�p�[�[�P��j�Q���AIL-1���`���̐��n�E�����j�Q���邱�Ƃ�����������(Kinoshita
et al. J. Biol. Chem. 2005)�B�����̂��Ƃ���A��X�́ANLR�t�@�~���[�̒��Ԃɂ�Nod1�ANod2�ANLRP3�ANLRC4�Ȃǂɑ�\�����悤�ȉ��Ǒ��i���̃����o�[�̑��ɁAPYNOD��NLRP7�Ȃǂ̂悤�ȉ��Ǘ}�����̃����o�[�����݂���ƍl���Ă���B���݁A��X��PYNOD�`���̔����v���t�@�C����̃��x���ł̋@�\�A���Ƃ̊ւ��Ȃǂ̉𖾂�ڎw���Č�����i�߂Ă���B
|
|
|
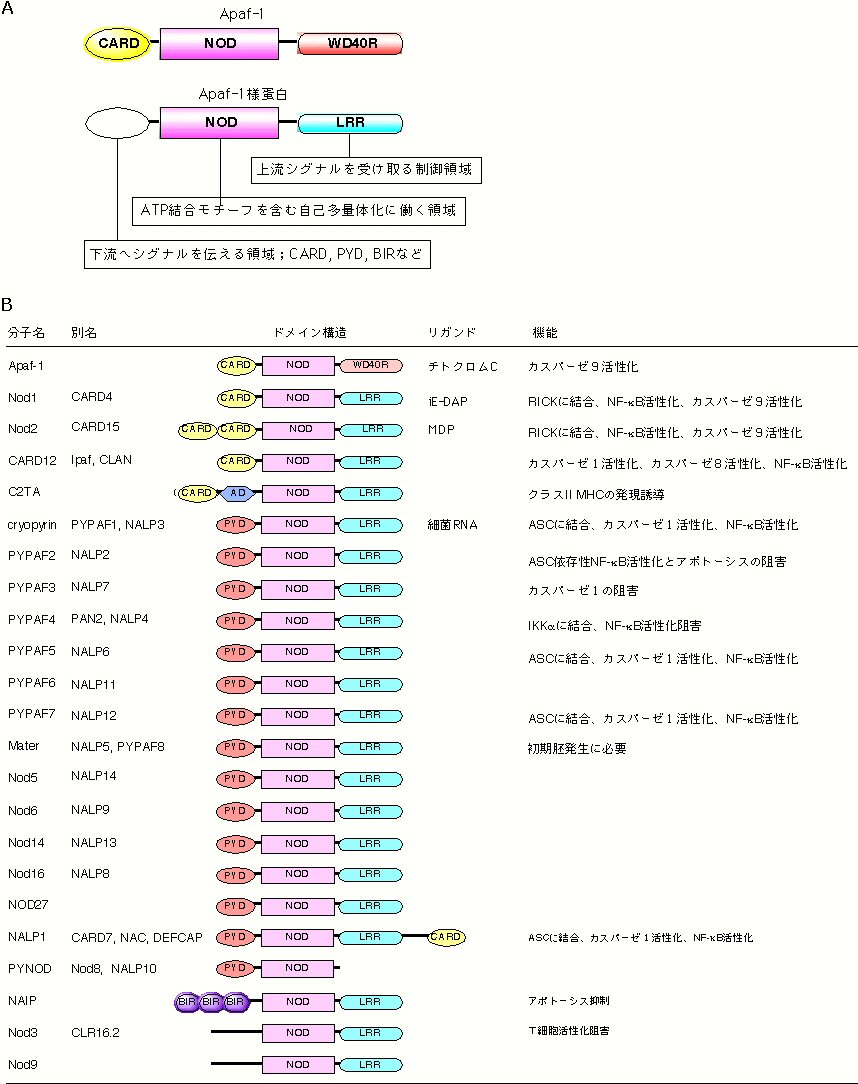
�} NLR�`���̊�{�\���Ƌ@�\ A. NLR�`���͉����ɃV�O�i����`�B���邽�߂̃G�t�F�N�^�[�h���C���AATP���������A���ȑ��ʑ̉��ɓ���NOD�A�㗬�̃V�O�i��������F������LRR����Ȃ�BB. �Q�m����͂Ȃǂ���A�q�g��20����z���郁���o�[����������Ă���B������NLR�`�����A�|�g�[�V�X�Ɖ��ǂ̗U���܂��͐���ɓ����Ă���B |